Аппарат корона для дарсонвализации: Купить Корона аппарат для Дарсонвализации (3 насадки) за 0 р. Перейти к Корона аппарат для Дарсонвализации (3 насадки).
Аппарат для местной дарсонвализации Корона (С+У) ⋆ Новатор ТМ
Количество товара Аппарат для местной дарсонвализации Корона (С+У)
Аппарат для местной дарсонвализации Корона С, С+У заменяет, а также дополняет и многократно усиливает эффективность действия кремов, мазей и масок. Для профилактики и лечения косметологических, дерматологических, неврологических, сосудистых, респираторных и других заболеваний.
Аппарат применяется в косметологии, спортивной медицине, в лечебно-профилактических учреждениях, а также в практике семейного врача, домашней физиотерапии.
Коронный разряд, который возникает между поверхностью тела и электродом, развивается не только в воздушном пространстве, но и в глубинах биологических тканей.
Электромагнитные излучения разнообразного диапазона, которые возникают в глубинах тканей, стимулируют обмен веществ, тканевое дыхание, нормализуют деятельность вегетативной нервной системы, деятельность эндокринных желез, способствует частичному рассасыванию солевых отложений в суставах, регенерации поврежденной ткани.
Особенно популярен использование аппарата в косметологической практике.
Аппарат позволяет проводить процедуры одновременно двум пациентам по индивидуальным режимам.
Время процедуры контролируется встроенными таймерами и об окончании процедуры информируется звуковым сигналом.
Интенсивность воздействия может корректироваться во время процедуры с визуальным контролем.
Аппарат изготавливается в двух исполнениях – два канала Дарсонваль, один канал Дарсонваль и один канал Ультратон.
Коронный разряд (Дарсонваль) стимулирует обмен веществ, тканевое дыхание, нормализуют деятельность эндокринных желез, способствуют частичному рассасыванию солевых конгломератов в суставах, регенерируется поврежденная ткань.
Ультратонотерапия обладает антисептическим, обезболивающим действием. Уменьшает отечность, ускоряет рассасывание инфильтратов, а озон, который образуется во время процедуры, предоставляет местный бактериостатический эффект – задерживает развитие микроорганизмов на поверхности кожи.
ОСНОВНЫЕ ТЕХНИЧЕСКИЕ ДАННЫЕ:
– режим дарсонвализации:
частота следования импульсов (100±10) Гц;
частота заполнения импульсов (110±15) кГц;
– режим УЛЬТРАТОН:
частота синусоидального выходного напряжения 22 кГц
эффективное значение максимального выходного напряжения от 1 до 3,5 кВ.
– аппарат работает от сети переменного тока частотой (50±0,5) Гц и напряжением (230±23) В;
– потребляемый ток не превышает 1 А;
– аппарат обеспечивает непрерывную работу в течение не более 8 час с последующим перерывом не менее 30 мин в повторно-кратковременном режиме: время работы не более 20 мин, время паузы не менее 10 мин;
– срок службы не менее трех лет;
В комплект поставки входит широкий спектр электродов:
Электрод полосной – 1 шт.
Электрод грибовидный малый – 1 шт.
Электрод грибовидный большой – 2 шт.
Электрод гребешковый – 2 шт.
Электрод ушной – 1 шт.
Электрод десенный – 1 шт.
Электрод вагинальный – 1 шт.
Электрод ректальный– 1 шт.
Электрод носовой – 1 шт.
Электрод бородавочный (только для дарсонвализации) – 1 шт.
Аппарат для местной дарсонвализации Корона (05) (CROWN) ⋆ Новатор ТМ
Количество товара Аппарат для местной дарсонвализации Корона (05) (CROWN)
Аппарат применяется в косметологии, спортивной медицине, в лечебно-профилактических учреждениях, а также в практике семейного врача, домашней физиотерапии. Простота и удобство аппарата в эксплуатации делает его незаменимым для использования в домашних условиях (по рекомендации врача).
Коронный разряд, который возникает между поверхностью тела и электродом, развивается не только в воздушном промежутке, но и в глубинах биологических тканей. Электромагнитные излучения разнообразного диапазона, которые возникают в глубинах тканей, стимулируют обмен веществ, тканевое дыхание, нормализуют деятельность вегетативной нервной системы, деятельность эндокринных желез, способствует частичному рассасыванию солевых отложений в суставах, регенерации поврежденной ткани.
Аппарат рекомендован для лечения таких заболеваний:
– Дерматология (экзема, лишай; угревая сыпь, юношеские угри, атопический дерматит, псориаз, красный плоский лишай; очаговая и системная склеродермия; ескудативний диатез келоидные рубцы; выпадение волос; себорея; перхоть).
– заболевания дыхательной системы (трахеиты; бронхиты бронхиальная астма).
– Заболевания желудочно-кишечного тракта (гастрит, дискинезия желудка и кишечника, воспаление стенки прямой кишки).
– Заболевания сердца и сосудов (кардиосклероз; миокардиодистрофия; ишемическая болезнь сердца; атеросклероз сосудов головного мозга гипертоническая болезнь).
– неврологические заболевания (остеохондроз позвоночника; невриты; сосудистые заболевания ЦНС (головные боли, включая мигрень, болезнь Рейно, акропарастезия, неврастения).
– гнойные и воспалительные процессы (фурункулы, ожоги; обморожения; удары; гематомы, послеоперационные инфильтраты и раны, трофические язвы).
– заболевания суставов (полиартрит; артрит спондилоартроз).
– заболевания мышц, сухожилий суставных сумок (боль в мышцах; миозит).
– заболевания артерий и вен (облитеруючийендартериит; болезнь Рейно варикозное расширение вен тромбофлебиты; трофические язвы).
– ЛОР заболевания (фарингит; тонзиллит; ангина; ларингит; отит, неврит слухового нерва шум в ушах ринит фронтит; гайморит; катары; насморк).
– Стоматологические заболевания (стоматит; пародонтоз; гингивит).
ТЕХНИЧЕСКИЕ ДАННЫЕ
– частота следования импульсов – (100 ± 10) Гц;
– частота заполнения импульсов – (110 ± 15) кГц
– амплитудное значение выходного напряжения плавно регулируется от минимального значения (не более 8 кВ) до максимального (от 16 до 25 кВ)
– аппарат работает от сети переменного тока частотой (50 ± 0,5) Гц и напряжением (230 ± 23) В. Возможна поставка аппарата с питанием от сети переменного тока 110В частотой 50 / 60Гц.
– потребляемый ток не более 0,5 А;
– включение аппарата в сеть сопровождается световой индикацией;
– аппарат обеспечивает непрерывную работу в течение не более 8:00 с последующим перерывом не менее 30 мин в повторно-кратковременном режиме: время работы не более 20 мин, время паузы не менее 10 мин;
– срок службы не менее трех лет.
– комплектуется полостным, грибовидным малым, гребенчатым, а также бородавочним электродами.
Дарсонвализация > Реабилитационный центр
Дарсонвализация – это терапевтическая процедура, при которой используется высокое напряжение переменного тока, подаваемое через наполненный газом стеклянный электрод. Во время процедуры используются импульсные синусоидальные токи высокой частоты (от 110 до 400 кГц) и напряжения (~20 кВ). Имеют очень малую мощность (в пределах 100-200 мА).
Метод дарсонвализации назван в честь французского физиолога д’Арсонваля. Прибор, используемый для этой процедуры, также называется Дарсонваль. Сегодня дарсонвализация эффективно применяется в косметологии, дерматологии, хирургии, гинекологии, урологии, лечении внутренних болезней, невропатологии и, конечно же, в нейрореабилитации.
При восстановлении больных после инсульта применение аппарата Дарсонваль позволяет улучшить кровообращение, активировать биохимические обменные процессы в коже и под ней, усилить питание тканей и снабжение кислородом, снизить порог чувствительности болевого рецептора и обеспечить обезболивающий эффект.
Регулярные сеансы дарсонвализации позволяют значительно улучшить функцию центральной нервной системы, а именно нормализовать сон, повысить работоспособность, повысить тонус сосудов, устранить боли в голове, снизить утомляемость. Также эта процедура благотворно влияет на работу иммунной системы.
К основным факторам, на которых основан аппарат Дарсонваль, относятся:
- Ток высокой частоты;
- Высоковольтный коронный разряд;
- Тепловой разряд в тканях тела, особенно в зоне коронного разряда;
- Небольшие количества оксидов азота и озона;
- Слабое ультрафиолетовое излучение, создаваемое коронным разрядом;
- Осцилляторный эффект (слабые механические колебания в тканях со сверхтонической частотой).
Дарсонвализация бывает общая и местная:
Дарсонвализация местная
Методика основана на подведении высокого напряжения к коже пациента через вакуумный электрод. Воздух внутри этого электрода либо полностью откачан, либо разбавлен. Низкое напряжение, вызывающее ионизацию воздуха, способствует развитию тихого электрического разряда, что широко используется в контактной методике воздействия. При повышении напряжения развивается вторичная самостоятельная ионизация воздуха, сопровождающаяся образованием искрового разряда, что используется как дистанционный метод воздействия (пустулы, прижигание сосудов, лифтинговая техника).
Воздух внутри этого электрода либо полностью откачан, либо разбавлен. Низкое напряжение, вызывающее ионизацию воздуха, способствует развитию тихого электрического разряда, что широко используется в контактной методике воздействия. При повышении напряжения развивается вторичная самостоятельная ионизация воздуха, сопровождающаяся образованием искрового разряда, что используется как дистанционный метод воздействия (пустулы, прижигание сосудов, лифтинговая техника).
Помимо применения местной дарсонвализации в реабилитации больных, перенесших инсульт, ее также можно применять при невритах слухового нерва, невралгиях, головных болях, миалгиях, вагинизме, кожном зуде, варикозном расширении вен голени, облитерирующих заболеваниях сосудов, первой обморожения второй степени, незаживающие язвы и раны.
Реакция на такого рода воздействие током высокой частоты при местной дарсонвализации может быть как сегментарной, так и локальной. Кратковременное спастическое сужение сосудов сменяется расширением их просвета, улучшается циркуляция лимфы и крови, уменьшаются явления венозного застоя, рассасываются воспалительные очаги, улучшается кровоток в тканях, что сопровождается увеличением количества кислорода в коже. Тихий разряд (и в большей степени искровой) оказывает бактерицидное действие.
Тихий разряд (и в большей степени искровой) оказывает бактерицидное действие.
Угнетается чувствительность рецепторов периферических нервов, что сопровождается сопутствующей блокадой проведения нервных импульсов в ЦНС, что, по-видимому, происходит из-за влияния, которое высокочастотный ток оказывает на нервные окончания. Функция сальных и потовых желез снижена. Через час после процедуры у человека может наблюдаться гиперемия и лейкоцитарная инфильтрация с умеренным отеком дермы, который проходит через сутки.
Общая дарсонвализация
В этом случае больной принимает положение лежа или сидя, а затем помещается в так называемую «клетку Дарсонваля», представляющую собой мощный виток колебательного контура. Эта процедура позволяет значительно замедлить свертываемость крови, нормализовать тонус сосудов головного мозга, понизить артериальное давление, устранить усталость и головные боли, улучшить сон и повысить работоспособность, благотворно повлиять на функции центральной нервной системы, а также на кровообращение капилляров. , вены и артерии. Кроме того, применение аппарата Дарсонваля способствует снятию спазмов сосудов и повышению общего иммунитета организма.
, вены и артерии. Кроме того, применение аппарата Дарсонваля способствует снятию спазмов сосудов и повышению общего иммунитета организма.
Основными действующими факторами общей дарсонвализации являются вихревые токи высокой частоты, направленные на поверхностные ткани больного по закону электромагнитной индукции.
Здесь вы также можете прочитать о других методах:
- Лимфодренажный массаж
- Тренажерный зал для мозга
- Фитбол
Для получения профессиональной консультации по Дарсонвализации
Пожалуйста, позвоните нам: +49228 972 723 72
или написать Email здесь
Журнал СТМ — Html View
Астафьева К.А., Иванова И.П.
Ключевые слова : газоразрядные технологии; излучение плазмы искрового разряда; ультрафиолетовая радиация; Дарсонваль коронный разряд.
Целью исследования был анализ цитотоксических эффектов различных газоразрядных технологий.
Материалы и методы. В работе использовались следующие газоразрядные устройства: «Пилимин» серий ИР-1, ИР-10 и «Бриг» — излучение плазмы искрового разряда; БРК-9ртутная лампа низкого давления — ультрафиолетовое излучение; Аппарат для дарсонвализации «Корона» — бесшумный электрический коронный разряд. Объектами исследования служили эритроциты крыс линии Вистар и лимфоидные клетки лимфосаркомы Плисса.
результатов. Установлено, что все исследованные газоразрядные устройства обладают мембранотоксическим и цитотоксическим действием. Общее количество эритроцитов и лимфоидных клеток уменьшалось, а количество нежизнеспособных клеток возрастало с увеличением времени экспозиции. Мембрана эритроцитов менее устойчива к излучению плазмы искрового разряда с длительностью импульса 1500 мкс и ультрафиолетовому излучению ртутной лампы, тогда как эритроциты менее устойчивы к излучению газоразрядных устройств, чем лимфоидные клетки. Клетки лимфосаркомы Плисса оказались более чувствительными к действию плазмы искрового разряда и коронного разряда с длительностью импульса 1–10 мкс. Излучение плазмы искрового разряда с длительностью импульса 150 мкс проявляло в равной степени мембранотоксическое и цитотоксическое действие.
Излучение плазмы искрового разряда с длительностью импульса 150 мкс проявляло в равной степени мембранотоксическое и цитотоксическое действие.
Заключение. Результаты оценки цитотоксического действия различных газоразрядных устройств позволяют определить направление исследований при изучении механизмов действия газоразрядных технологий и рекомендовать, в частности, более глубокое изучение такого параметра, как длительность импульсного разряда .
Возрастающее число опухолевых и инфекционных процессов, резистентных к традиционным методам лечения (лучевая терапия, химиотерапия, антибиотикотерапия), обусловливают поиск и разработку новых эффективных методов торможения пролиферативной активности опухолевых и прокариотических клеток, обладающих цитотоксическим действием и не вызывающих выраженного токсическое действие на организм в целом. В связи с этим большой интерес представляют газоразрядные плазменные технологии, применяемые как в России, так и за рубежом [1–3]. В России широко применяются такие медицинские газоразрядные устройства, как кварцевая лампа (разряд паров ртути) [4] и аппарат для дарсонвализации (тихий коронный разряд) [5]. Исследуются биологические эффекты недавно разработанных газоразрядных установок «Бриг» (Саров, Нижегородская область, Россия) и «Пилимин» (Москва, Россия), основанных на излучении плазменного искрового разряда [6–9].].
В России широко применяются такие медицинские газоразрядные устройства, как кварцевая лампа (разряд паров ртути) [4] и аппарат для дарсонвализации (тихий коронный разряд) [5]. Исследуются биологические эффекты недавно разработанных газоразрядных установок «Бриг» (Саров, Нижегородская область, Россия) и «Пилимин» (Москва, Россия), основанных на излучении плазменного искрового разряда [6–9].].
Для оценки эффективности цитотоксического действия любого физического или химического фактора необходимо провести первичный скрининг по оценке устойчивости мембраны и клетки в целом к исследуемому действию. Анализ структурно-функционального состояния фосфолипидного бислоя клеток позволяет оценить глубину мембранотоксического действия. Скрининговые исследования позволяют исследователям предлагать рекомендации по разработке новых и оптимизации существующих медицинских устройств.
Целью исследования был анализ цитотоксического действия различных медицинских газоразрядных устройств.
Материалы и методы. В работе использовались следующие газоразрядные устройства: Корона (Новатор, Украина) — бесшумный электрический коронный разряд, длительность импульса 10 мкс, частота следования импульсов 100±10 Гц, выходное напряжение 16 кВ; Пилимин ИР-1 (Институт ядерной физики им. Д.В. Скобельцина МГУ, Москва, Россия) — импульсное излучение плазмы искрового разряда (200–800 нм), длительность импульса 1500 мкс, энергия в импульсе 1,8 Дж, частота импульсов 1 Гц; Пилимин ИР-10 — импульсное излучение плазмы искрового разряда (200–800 нм), длительность импульса 150 мкс, 5,9·10 –2 Дж энергии в импульсе, частота импульсов 10 Гц; Бриг (Российский федеральный ядерный центр, г. Саров, Нижегородская область, Россия) — импульсное излучение плазмы искрового разряда (200–800 нм), длительность импульса 1–4 мкс, энергия в импульсе 5 Дж, частота импульсов 1 Гц; Ртутная лампа низкого давления ДБК-9 (Солнышко, Россия) — ультрафиолетовое излучение (220–400 нм), разряд генерируется в парах ртути, мощность 9 Вт, средний поток фотонов ультрафиолетового излучения 5,4·10 –10 моль (см 2 ·s) –1 .
В эксперименте использовали суспензии эритроцитов крысы Вистар и суспензии лимфоидных клеток лимфосаркомы Плисса. Штамм клеток был получен от Н.Н. Блохина Российского онкологического научного центра (Москва, Россия).
Взвесь эритроцитов готовили следующим образом: животным внутрибрюшинно вводили 0,2 мл гепарина, декапитировали под эфирным наркозом, собирали цельную кровь в пробирку с 0,2 мл гепарина и центрифугировали при 3000 об/мин. Эритроциты разводили в 1000 раз раствором Хэнкса («Биолот», Россия) с конечной концентрацией (5–8)·10 9 .0100 7 клеток/мл.
Работа выполнена в соответствии с этическими принципами, установленными Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (конвенция принята в Страсбурге 18 марта 1986 г., принята в Страсбурге 15 июня 2006 г.) и одобрена Комитет по этике Нижегородской государственной медицинской академии.
Суспензию лимфоидных клеток получали путем разрушения ткани лимфосаркомы Плисса в растворе Хенкса, а затем доводили до конечной концентрации (5–7)·10 6 клеток/мл.
Для оценки цитотоксического действия клетки в объеме 4 мл и в стерильных пластиковых чашках Петри диаметром 40 мм подвергали воздействию исследуемых физических факторов в течение 30 с; 60; 120; 300; 600; 1200; 2400; 3600 с. Контролем служили необработанные взвеси эритроцитов и лимфоидных клеток.
Общее количество клеток после воздействия определяли с помощью автоматического цитометра Sceptor (Merck Millipore, США). Количество нежизнеспособных клеток после инкубации с трипановым синим оценивали микроскопически (Leica BME; Leica Microsystems, Германия) в камере для подсчета клеток в течение 5 мин (5 мг/10 мл стерильного физиологического раствора).
Микровязкость в зоне белково-липидных контактов и липидном бислое мембран определяли по флуоресценции пиренового зонда (Sigma-Aldrich, США), разведя в 20 раз раствор пирена в 0,85 мг/мл этанола [10]. Степень гидрофобности определяли по флуоресценции 1,6-дифенил-1,3,5-гексатриенового (ДФГ) зонда (Sigma-Aldrich, США), для исследования использовали раствор ДФГ в 1 мг/мл гексана. разводят в 100 раз [11]. Измерения проводились на спектрофлуориметре «Флюорат-02 Панорама» («Люмэкс», Россия).
разводят в 100 раз [11]. Измерения проводились на спектрофлуориметре «Флюорат-02 Панорама» («Люмэкс», Россия).
Данные, полученные в эксперименте, обрабатывали с помощью пакетов прикладных программ Exel, Statistica 8.0. Результаты представлены в виде M±m, где M – среднее арифметическое, m – ошибка среднего. Статистическую значимость различий средних определяли с помощью параметрического критерия Стьюдента. Различия считали достоверными при р<0,05.
Результаты и обсуждение. Снижение общего числа клеток после воздействия свидетельствует о наличии цитотоксического действия. Одной из наиболее удобных моделей оценки мембранной резистентности являются эритроциты. Поэтому на первом этапе оценивали изменение общего числа этих клеток после воздействия. Для всех испытуемых устройств установлено, что общее количество эритроцитов с увеличением времени экспозиции уменьшается, а количество нежизнеспособных клеток увеличивается (рис. 1, а). В ходе исследования определяли временные режимы, при которых наблюдался 50% цитотоксический эффект. Для Пилимин ИР-1, ИР-10 и БК-9для ртутной лампы это время составило 30 с, для Брига — 60 с, для Короны (коронный разряд Дарсонваля) это время составило 300 с. 100% цитотоксический эффект зарегистрирован после воздействия излучения ДБК-9 и Пилимин ИР-10 в течение 600 с. Для Брига и Короны гемолиз эритроцитов не отмечался даже после максимального времени экспозиции (3600 с), во взвеси оставалось 9 и 27% клеток соответственно.
Для Пилимин ИР-1, ИР-10 и БК-9для ртутной лампы это время составило 30 с, для Брига — 60 с, для Короны (коронный разряд Дарсонваля) это время составило 300 с. 100% цитотоксический эффект зарегистрирован после воздействия излучения ДБК-9 и Пилимин ИР-10 в течение 600 с. Для Брига и Короны гемолиз эритроцитов не отмечался даже после максимального времени экспозиции (3600 с), во взвеси оставалось 9 и 27% клеток соответственно.
| | Рис. 1. Изменения эритроцитов после облучения газоразрядными приборами: а — общее количество клеток; (б) количество нежизнеспособных клеток; * статистическая значимость различий с контрольной группой, р<0,05 |
Автоматический цитометр может определить общее количество клеток, но не их жизнеспособность. Поэтому для выявления нежизнеспособных клеток использовали витальный тест с трипановым синим.
Установлено, что количество нежизнеспособных клеток увеличивается с увеличением времени облучения суспензии эритроцитов тестируемыми устройствами (рис.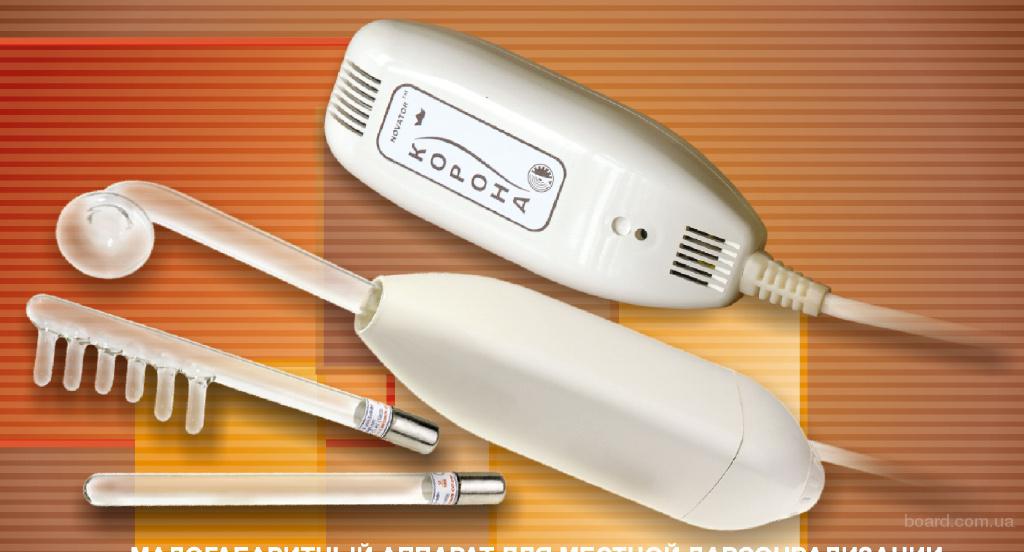 1, б).
1, б).
После облучения ДБК-9 наблюдался полный гемолиз эритроцитов.ртутная лампа и установка искрового разряда плазмы «Пилимин ИР-1» на 1200 с. После максимального воздействия плазмы Брига в течение 3600 с в суспензии не осталось жизнеспособных эритроцитов, а после воздействия коронного излучения 46% клеток сохраняют жизнеспособность, а 56% нежизнеспособны.
Таким образом, мембраны эритроцитов крыс оказались более устойчивыми к плазменному воздействию аппаратов Бриг и Корона, что, вероятно, связано с меньшей длительностью импульса (1–10 мкс) по сравнению с Пилимином ИР-1 и ИР-10 с 150 и 1500 мкс длительность импульса. Известно, что при малой длительности импульса накопление радикалов и активных частиц в субстрате происходит медленнее [4], поэтому и эритроциты в такой ситуации медленнее гемолизируются, и большее количество клеток сохраняет жизнеспособность. Белковый цитоскелет эритроцитов, отвечающий за эластичность и целостность мембраны [12], в большей степени подвергается деструктивным изменениям после воздействия плазмы искрового разряда с длительностью импульса 1500 мкс и ультрафиолетового излучения ртутной лампы.
На следующем этапе было проанализировано влияние газоразрядных устройств на изменение общей численности и жизнеспособности лимфоидных клеток, так как эти клетки обладают более сложной организацией, чем эритроциты, имеют ядро и внутриклеточные органеллы. Установлено, что общее количество лимфоидных клеток уменьшалось с увеличением времени воздействия (рис. 2, а), а количество нежизнеспособных клеток возрастало (рис. 2, б). После облучения Пилимином ИР-10 и Короной в течение 30 с, ртутной лампой и Бригом в течение 120 с, Пилимином ИР-1 в течение 600 с наблюдался 50% лизис клеток. 100% цитотоксического эффекта при максимальном времени воздействия (3600 с) не установлено. Однако количество нежизнеспособных клеток после 3600 с воздействия излучения Пилимин ИР-1 составило 75%, ДБК-9— 86%, «Пилимин ИР-10» — 66%, «Бриг» — 83%, «Корона» — 52%.
| | Рис. 2. Изменения лимфоидных клеток после облучения газоразрядными устройствами: а — общее количество клеток; (б) количество нежизнеспособных клеток; * статистическая значимость различий с контрольной группой, р<0,05 |
Таким образом, все рассмотренные газоразрядные устройства обладают как мембранотоксическим, так и цитотоксическим действием. Лимфоидные клетки более устойчивы к облучению плазмой искрового разряда Пилимина ИР-1, тогда как мембраны эритроцитов, наоборот, более чувствительны к нему. Длительность импульса излучения плазмы искрового разряда данного прибора в 1000 раз больше, чем у прибора «Бриг» и в 100 раз у прибора «Пилимин ИР-10». Именно большая длительность импульса, скорее всего, имеет значение для деструкции и лизиса эритроцитов, а для ядерных клеток с многочисленными мембранными образованиями (ядерная мембрана, комплекс Гольджи, эндоплазматический ретикулум и др.) снижение жизнеспособности связано с интегральным накоплением деструктивных изменений в мембранных структурах при меньшей длительности импульсного излучения. Этот факт позволяет сделать вывод о необходимости учета такого параметра, как длительность разрядного импульса, при разработке биомедицинских газоразрядных устройств.
Лимфоидные клетки более устойчивы к облучению плазмой искрового разряда Пилимина ИР-1, тогда как мембраны эритроцитов, наоборот, более чувствительны к нему. Длительность импульса излучения плазмы искрового разряда данного прибора в 1000 раз больше, чем у прибора «Бриг» и в 100 раз у прибора «Пилимин ИР-10». Именно большая длительность импульса, скорее всего, имеет значение для деструкции и лизиса эритроцитов, а для ядерных клеток с многочисленными мембранными образованиями (ядерная мембрана, комплекс Гольджи, эндоплазматический ретикулум и др.) снижение жизнеспособности связано с интегральным накоплением деструктивных изменений в мембранных структурах при меньшей длительности импульсного излучения. Этот факт позволяет сделать вывод о необходимости учета такого параметра, как длительность разрядного импульса, при разработке биомедицинских газоразрядных устройств.
Сравнивая цитотоксическое действие газоразрядных технологий на эритроциты и лимфоидные клетки, можно сделать вывод, что опухолевые лимфоидные клетки более устойчивы к воздействию испытанных газоразрядных устройств, так как их большее количество, по сравнению с эритроцитами, сохраняет свою целостность и жизнеспособность при увеличение времени экспозиции, что, вероятно, связано с более крупными размерами (8–18 мкм, что в 3–4 раза больше размеров эритроцитов), наличием хорошо сформированного ядра, органелл, а также с повышенной метаболической активностью опухолевых клеток [13].
Следует отметить, что исследование резистентности и жизнеспособности клеток не позволяет в полной мере оценить нарушения структурно-функциональной организации мембран. Поэтому такие дополнительные параметры, как гидрофобность и микровязкость липидного бислоя и белково-липидных контактов, изучали по флуоресценции 1,6-дифенилгексатриеновых и пиреновых зондов. Установлено, что гидрофобные свойства мембраны по интенсивности флуоресцентного зонда 1,6-дифенилгексатриена зависят как от времени экспозиции, так и от используемого газоразрядного устройства (рис. 3).
| Рис. 3. Интенсивность флуоресценции 1,6-дифенилгексатриена в бислое лимфоидных клеток после облучения газоразрядными приборами; * статистическая значимость различий с контрольной группой, р<0,05 |
Гидрофобность мембран возрастает с увеличением времени облучения суспензии лимфоидных клеток ДБК-9.ртутной лампы и прибора Брига в 5,3 и 2 раза соответственно, что может свидетельствовать об уплотнении фосфолипидного бислоя за счет окисления двойных связей жирных кислот и, в конечном счете, о снижении проницаемости мембраны [14]. При облучении плазмой искрового разряда приборов «Пилимин ИР-1» и «ИР-10» гидрофобность уменьшается соответственно в 1,76 и 1,75 раза с увеличением времени воздействия. В этом случае снижение гидрофобности, вероятно, связано с разрыхлением фосфолипидного бислоя и повышением проницаемости клеток [14]. Гидрофобность мембран после облучения Короной не меняется, следовательно, не меняются проницаемость мембран и степень окисления фосфолипидов жирных кислот.
При облучении плазмой искрового разряда приборов «Пилимин ИР-1» и «ИР-10» гидрофобность уменьшается соответственно в 1,76 и 1,75 раза с увеличением времени воздействия. В этом случае снижение гидрофобности, вероятно, связано с разрыхлением фосфолипидного бислоя и повышением проницаемости клеток [14]. Гидрофобность мембран после облучения Короной не меняется, следовательно, не меняются проницаемость мембран и степень окисления фосфолипидов жирных кислот.
Микровязкость липидного бислоя и белково-липидных контактов изучали с помощью эксимеризации пиренового зонда. Установлено, что с увеличением времени облучения плазменными аппаратами искрового разряда «Пилимин» серий ИР-1 и ИР-10 и «Бриг» микровязкость бислоя лимфоидных клеток уменьшается в 1,5 раза (рис. 4, а) и, следовательно, подвижность фосфолипидные цепи жирных кислот растут. Воздействие ультрафиолетового излучения ртутной лампы ДБК-9 в течение 1200 с приводит к повышению микровязкости на 32%, что свидетельствует о снижении подвижности фосфолипидов и, вероятно, снижении проницаемости мембран. Статистически значимых различий гидрофобности мембран после воздействия коронным разрядом Дарсонваля не выявлено.
Статистически значимых различий гидрофобности мембран после воздействия коронным разрядом Дарсонваля не выявлено.
| Рис. 4. Изменение микровязкости фосфолипидного бислоя (а) и белково-липидных контактов лимфоидных клеток (б) после облучения газоразрядными приборами, определяемое по интенсивности флуоресценции пиренового зонда; * статистическая значимость различий с контрольной группой, р<0,05 |
Известно, что флуоресцентный пиреновый зонд связывается с фосфолипидами жирных кислот и встраивается в гидрофобные области. Флуоресценция пирена чувствительна к изменениям микроокружения белков и липидов [10].
Микровязкость белково-липидных контактов (рис. 4, б) уменьшается в процессе облучения ртутными лампами Пилимин серий ИР-1 и ИР-10 и ДБК-9 в 1,9, 2,4 и 4,07 раза соответственно. Под действием плазмы Брига наблюдается двукратное увеличение микровязкости.
Из работ Лоры и др. [15] известно, что пирен ковалентно связывается с боковыми цепями белков в фосфолипидном бислое, поэтому как увеличение, так и уменьшение эксимеризации пирена свидетельствует о разрушении ковалентных связей белков и липидов после облучения. Изменение таких параметров, как микровязкость и гидрофобность, будет нарушать работу клеточных транспортных АТФаз и рецепторных систем, изменять проницаемость мембран и в конечном итоге приводить к гибели клеток [16].
[15] известно, что пирен ковалентно связывается с боковыми цепями белков в фосфолипидном бислое, поэтому как увеличение, так и уменьшение эксимеризации пирена свидетельствует о разрушении ковалентных связей белков и липидов после облучения. Изменение таких параметров, как микровязкость и гидрофобность, будет нарушать работу клеточных транспортных АТФаз и рецепторных систем, изменять проницаемость мембран и в конечном итоге приводить к гибели клеток [16].
Таким образом, все рассмотренные устройства обладают цитотоксическим и мембранотоксическим действием. Однако эритроциты более устойчивы к коронным разрядам Дарсонваля и плазме искрового разряда с длительностью импульса 1–10 мкс, но менее устойчивы к ультрафиолетовому излучению ртутной лампы и плазме искрового разряда с большой длительностью импульса. Лимфоидные клетки лимфосаркомы Плисса более чувствительны к облучению плазмой искрового разряда и коронного разряда с короткой длительностью импульса, более устойчивы к ультрафиолетовому излучению ртутной лампы, а также плазме искрового разряда с длительностью импульса 1500 мкс.
Излучение плазмы искрового разряда и ультрафиолетовое излучение ртутной лампы индуцируют повреждение мембранных структур клетки, т.е. обладают более выраженным мембранотоксическим действием, тогда как цитотоксическое действие коронного разряда Дарсонваля, вероятно, больше связано с метаболическими изменениями в клетке, чем с нарушениями в мембранных фосфолипидах. Излучение плазмы искрового разряда с длительностью импульса 150 мкс проявляет в равной степени мембранотоксическое и цитотоксическое действие.
Заключение. Результаты оценки цитотоксического действия различных газоразрядных устройств позволяют определить направления исследований при изучении механизмов действия газоразрядных технологий и рекомендовать, в частности, более глубокое изучение такого параметра, как длительность импульсного разряда .
Финансирование исследования и конфликты интересов. Работа не была поддержана каким-либо источником, и конфликты интересов, связанные с этим исследованием, отсутствуют.
Каталожные номера
- Сасаи Ю., Кондо С., Ямаути Ю., Кузуя М. Плазменная модификация поверхности полимерного субстрата для контроля клеточной адгезии. J Photopolym Sci Technol 2010; 23(4): 595–598, https://doi.org/10.2494/photopolymer.23.595.
- Стейнбек М.Ю., Чернец Н., Чжан Дж., Курпад Д.С., Фридман Г., Фридман А., Фриман Т.А. Дифференцировка скелетных клеток усиливается при обработке плазмой атмосферного диэлектрического барьерного разряда. ПЛоС Один 2013; 8(12): e82143, https://doi.org/10.1371/journal.pone.0082143.
- Иванова И.П., Заславская М.И. Биоцидный эффект некогерентного импульсного излучения искрового разряда в опытах in vitro и in vivo. Современные технологии в медицине 2009; 1: 28–31.
- Пискарев И.М., Иванова И.П., Трофимова С.В. Сравнение химических эффектов УФ-излучения искрового разряда в воздухе и ртутной лампы низкого давления. Химия высоких энергий 2013; 47(5): 247–250, https://doi.
 org/10.1134/s0018143913050093.
org/10.1134/s0018143913050093. - Зискин М.С. Миллиметровые волны: акустические и электромагнитные. Биоэлектромагнетизм 2012; 34(1): 3–14, https://doi.org/10.1002/bem.21750.
- Иванова И.П., Проданец Н.В., Спиров Г.М. Морфологические изменения внутренних органов крыс с трансплантируемой лимфосаркомой Плисса при воздействии некогерентного импульсного излучения. Морфология; 2004 г.; 4: 52.
- Архипова Е.В., Иванова И.П. Влияние некогерентного импульсного излучения на функциональное состояние мононуклеаров в эксперименте. Современные технологии в медицине 2013; 5(1): 27–31.
- Иванова И.П., Трофимова С.В., Ведунова М.В., Жаберева А.С., Бугрова М.Л., Пискарёв И.М., Карпель Вель Лейтнер Н. Оценка механизмов цитотоксического действия газоразрядного плазменного излучения. Современные технологии в медицине 2014; 6(1): 14–22.
- Иванова И.П., Трофимова С.В., Карпель Вель Лейтнер Н., Аристова Н.А., Архипова Е.В., Бурхина О.Е., Сысоева В.А., Пискарев И.
 М. Анализ активных продуктов определения излучения плазмы искрового разряда биологические эффекты в тканях. Современные технологии в медицине 2012; 2: 20–30.
М. Анализ активных продуктов определения излучения плазмы искрового разряда биологические эффекты в тканях. Современные технологии в медицине 2012; 2: 20–30. - Бейнс Г., Патель А.Б., Нараянасвами В. Пирен: зонд для изучения конформации белка и конформационных изменений. Молекулы 2011; 16(12): 7909–7935, https://doi.org/10.3390/molecules16097909.
- Драхота З., Паленикова Е., Эндлихер Р., Милерова М., Брейхова Ю., Восахликова М., Свобода П., Каздова Л., Калоус М., Червинкова З., Цахова М. Бигуаниды ингибируют комплексы I, II и IV митохондрий печени крысы и модифицируют их функциональные свойства. Физиол Рес 2014; 63(1): 1–11.
- Salcedo-Sicilia L., Granell S., Jovic M., Sicart A., Mato E., Johannes L., Balla T., Egea G. Спектрин βIII регулирует структурную целостность и транспорт секреторных белков комплекса Гольджи. J Биол Хим 2012; 288(4): 2157–2166, https://doi.org/10.1074/jbc.m112.406462.
- Джужа Д.А. Диагностическая эффективность позитронно-эмиссионной томографии с 18F-фтордезоксиглюкозой в онкологии.



 org/10.1134/s0018143913050093.
org/10.1134/s0018143913050093. М. Анализ активных продуктов определения излучения плазмы искрового разряда биологические эффекты в тканях. Современные технологии в медицине 2012; 2: 20–30.
М. Анализ активных продуктов определения излучения плазмы искрового разряда биологические эффекты в тканях. Современные технологии в медицине 2012; 2: 20–30.