Что такое гидрохинон – Что такое гидрохинон, применение в косметологии: отбеливающие кремы, пилинг, мазь, таблетки. Ахроактив макс, отзывы
Гидрохинон — Википедия
| Гидрохинон | |||
|---|---|---|---|
| |||
 ( ({{{изображение}}}) | |||
| Систематическое наименование | бензол-1,4-диол | ||
| Хим. формула | C6H6O2 | ||
| Молярная масса | 110,11 г/моль | ||
| Плотность | 1.36 г/см³ | ||
| Энергия ионизации | 7,95 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | 173,8—174,8 °C | ||
| • кипения | 286,5 °C | ||
| • вспышки | 165 °C | ||
| Давление пара | 1,0E-5 ± 0,00001 мм рт.ст.[1] | ||
| Растворимость | |||
| • в воде | 5,26 г/100 мл (5 °С) 21,21 г/100 мл (50 °С) 56,25 г/100 мл (70 °С) | ||
| • в спирте | 127,27 г/100 г | ||
| • в ацетоне | 77,94 г/100 г | ||
| Рег. номер CAS | 123-31-9 | ||
| PubChem | 785 | ||
| Рег. номер EINECS | 204-617-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | MX3500000 | ||
| ChEBI | 17594 | ||
| ChemSpider | 764 | ||
| ЛД50 | 302 мг/кг (крысы, перорально) | ||
| Пиктограммы СГС |     | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
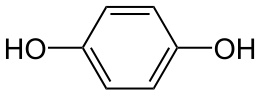
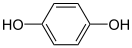
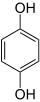
Гидрохино́н (пара-дигидроксибензол, бензол-1,4-диол, хинол) — ароматическое органическое соединение, представитель двуатомных фенолов с химической формулой C6H4(OH)2, изомер пирокатехина и резорцина. Название «гидрохинон» дано соединению Ф. Вёлером из-за схожести свойств с хиноном, из которого Вёлер его синтезировал. Сильный восстановитель, используется как проявитель в фотографии, антиоксидант в химической промышленности, реагент для определения ниобия, вольфрама, золота и цезия в аналитической химии.
Торговое наименование: H-142[2].
 | ||||||||||
Ж. Б. Каванту (слева) и П. Ж. Пеллетье (справа), впервые получившие гидрохинон | ||||||||||
Впервые был выделен французскими химиками Пьером Жозефом Пеллетье и Жозефом Бьенеме Каванту при перегонке хинной кислоты в 1820 году. Синтез гидрохинона первым осуществил Фридрих Вёлер в 1844 году восстановлением хинона. Также Вёлер дал ему современное название и описал его свойства[3].
Уильям Эбней в 1880 году обнаружил проявляющие свойства соединения, что привело к разработке способов промышленного синтеза. Дальнейшие опыты с гидрохиноном привели к созданию проявителей с двумя проявляющими веществами. Первый из таких проявителей получил Генри Дж. Ньютон в 1889 году, добавив гидрохинон к эйконогеновому проявителю, и получив итоговый состав, который использовал лучшие свойства обоих проявляющих веществ. Вскоре после этого были предложены метол-гидрохиноновые проявители (обозначающиеся символами
Открытие Дж. Д. Кендаллом проявляющей способности фенидона в 1940 году привело к созданию еще более эффективной системы фенидон-гидрохиноновых проявителей (PQ в англоязычной литературе). Фенидон мало пригоден для использования в качестве единственного проявляющего вещества, так как дает сильное вуалирование фотоматериала, но в супераддитивных проявителях с гидрохиноном эта особенность исчезает, давая качественное итоговое изображение, значительное ускорение процесса обработки, меньшую токсичность и другие преимущества по сравнению с метол-гидрохиноновыми составами[5][6].
Белые или бесцветные призматические кристаллы, сладковатые на вкус
Растворим в воде (5,26 г/100 мл при 5 °С, 21,21 г/100 мл при 50 °С, 56,25 г/100 мл при 70 °С), спирте (127,27 г/100 г), ацетоне (77,94 г/100 г). Образует клатраты. В частности, клатрат с метанолом имеет формулу 3C6H6O
Реактив может содержать примеси, выглядящие как нерастворимый чёрный порошок. Количество примесей возрастает при длительном или неправильном хранении и при их большом количестве реактив становится непригодным к использованию[9].
Является сильным восстановителем. Процесс взаимодействия с окислителями происходит в два этапа — на первом гидрохинон превращается в хингидрон, на втором — в 4-бензохинон[8].
При взаимодействии с водным раствором карбоната калия при 130 °С превращается в 2,5-дигидроксибензойную кислоту, с метиламином под давлением при 200 °С образует 4-метиламинофенол, с малеиновым ангидридом — нафтазарин, с фталевым ангидридом дает хинизарин. Образует простые моно- и диэфиры при обработке алкилирующими реагентами
Аналитическое определение[править | править код]
Гидрохинон может быть определён при помощи цветных реакций[8]:
Фотографическое проявление[править | править код]
Обладает проявляющими свойствами, восстанавливая бромистое серебро в щелочных растворах с образованием 4-бензохинона и бромоводорода[10] с общим уравнением:
 + 2 AgBr →OH−{\displaystyle {\ce {->[OH^{-}]}}}
+ 2 AgBr →OH−{\displaystyle {\ce {->[OH^{-}]}}}  + 2 Ag + 2 HBr
+ 2 Ag + 2 HBr
Проявление начинается при pH выше 9,5[11]. Процесс состоит из нескольких стадий[12]:
- в щелочной среде гидрохинон диссоциирует в дианион гидрохинона[13]:
 ⇌H+OH−{\displaystyle {\ce {<=>[OH^-][H^+]}}}
⇌H+OH−{\displaystyle {\ce {<=>[OH^-][H^+]}}}  + 2H+
+ 2H+
- дианион гидрохинона окисляется на центре проявления с образованием на первой стадии иона семихинона и 4-бензохинона на второй[14]:
 ⇌−e−{\displaystyle {\ce {<=>[-e^-]}}}
⇌−e−{\displaystyle {\ce {<=>[-e^-]}}}  ⇌−e−{\displaystyle {\ce {<=>[-e^-]}}}
⇌−e−{\displaystyle {\ce {<=>[-e^-]}}} 
- ионы серебра восстанавливаются до металлического серебра[14]:
- 2Ag+ + 2e—⟶{\displaystyle {\ce {->}}} 2Ag
Изначально гидрохинон был получен из хинона. Разные варианты данного способа по-прежнему применяют для лабораторного получения реактива; для этого, например, проводят восстановление водного раствора 4-бензохинона, используя диоксид серы[8][15].
В промышленности синтезируют следующими способами[8]:
- окислением 1,4-диизопропилбензола воздухом, затем проводят кислотный гидролиз полученного бис-гидропероксида с образованием гидрохинона и ацетона;
- гидроксилированием фенола 70 % перекисью водорода при 90 °С с использованием в качестве катализаторов 75 % ортофосфорную кислоту или 65 % хлорную кислоту. В результате реакции образуется смесь гидрохинона и пирокатехина, которую в дальнейшем разделяют ректификацией;
- взаимодействием фенола и ацетона с образованием 4-изопропилфенола, который окисляют перекисью водорода в кислой среде с образованием гидрохинона и ацетона;
- окислением сернокислого анилина двуокисью марганца или хромовой кислотой до 4-бензохинона, затем восстанавливают 4-бензохинон порошкообразным железом в воде при 70—80 °С в присутствии гидросульфита натрия с общим выходом реакции 74—84 %.
Технические условия выпуска гидрохинона в СССР и Российской Федерации установлены ГОСТ 19627-74[16]. В соответствии с ним выпускается два сорта реактива — высший и первый. Высший сорт выглядит как белый или серовато-белый порошок и содержит 99,5 % основного вещества, первый — как белый с желтоватым оттенком и содержит 99 % основного вещества[17].
Хотя при промышленном производстве обычно получают достаточно чистый реактив, но при необходимости можно получить большую степень очистки, перекристаллизовав продажный реактив из тщательно обескислороженной воды[18].
Оценка производственных мощностей США по производству гидрохинона составляла порядка 11,3 тыс. тонн в год (по состоянию на 1965 г.)[19].
Применяется:
Применение в аналитической химии[править | править код]
Используется при[8]:
Применение в фотографии[править | править код]
Как единственное проявляющее вещество обычно применяется только в специальных проявителях, предназначенных для получения высокой оптической плотности, например для целей репродуцирования или полиграфии, либо для получения коричневой окраски на бромосеребряных фотобумагах[17].
Составы с гидрохиноном чувствительны к изменениями температуры: оптимальной является 18 °C, при 19 °C скорость работы нормальная, но уже при 20 °C начинается вуалирование; при снижении температуры до 10 °C проявление практически останавливается и при достижении 5 °C прекращается полностью[17].
Обычно применяется в проявителях вместе с метолом или фенидоном, при этом вуалирующая способность, присущая гидрохинону, исчезает[17].
По состоянию на 2006 год известно о запрете лекарственных препаратов в Нигерии, содержащих более 5 % гидрохинона, из-за их нецелевого использования, а также о существовании в Германии ограничений на использование препаратов с гидрохиноном, где они могут применяться только для случаев патологической пигментации и не могут применяться для детей и подростков младше 12 лет[20].
Обладает слабым дезинфекционным действием, аналогичным тому, который оказывает фенол[8].
В больших количествах токсичен. LD50 составляет 302 мг/кг (крысы, перорально). При попадании в организм окисляется до 4-бензохинона, превращающего гемоглобин в метгемоглобин. Может вызывать поражение глаз — конъюнктивит, и кожи — дерматит. ПДК для аэрозоля составляет 2 мг/м3. Рейтинг NFPA 704: опасность для здоровья: 2, огнеопасность: 1, нестабильность: 1. Подтверждена канцерогенность для животных с неизвестной релевантностью для человека[21][8][2].
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0338.html
- ↑ 1 2 3 Гурлев, 1988, с. 278.
- ↑ 1 2 Стилл, 1976, с. 485.
- ↑ Suzuki, 2006, с. 385.
- ↑ Allen, 2011, с. 257.
- ↑ Suzuki, 2006, с. 385—386.
- ↑ Медведев, 1929.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Карпова, 1988.
- ↑ Гурлев, 1988, с. 279.
- ↑ Редько, 2006, с. 855.
- ↑ Редько, 2006, с. 856.
- ↑ Редько, 2006, с. 863—864.
- ↑ Редько, 2006, с. 863.
- ↑ 1 2 Редько, 2006, с. 864.
- ↑ Прянишников, 1956, с. 112.
- ↑ ГОСТ.
- ↑ 1 2 3 4 Гурлев, 1988, с. 278—279.
- ↑ Стилл, 1976, с. 488.
- ↑ Стилл, 1976, с. 487.
- ↑ 1 2 UN, 2006, с. 116.
- ↑ Fisher Scientific.
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988. — 335 с. — ISBN 5-335-00125-4.
- Карпова Н. Б. Гидрохинон : статья // Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М. : Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 570. — 623 с.
- Медведев С. Гидрохинон : статья // Техническая энциклопедия / гл. ред. Мартенс Л. К.. — М. : Акционерное общество «Советская энциклопедия», 1929. — Т. 5. — С. 569.
- Мономеры для поликонденсации / под ред. Дж. Стилла, Т. У. Кэмпбелла; пер. с англ. Выгодского Я. С., ред. Коршак В. В. — Мир, 1976.
- Прянишников Н. Д. Практикум по органической химии. — М.: Государственное научно-техническое издательство химической литературы, 1956. — 244 с.
- Редько А. В. Химия фотографических процессов. — СПб. : НПО «Профессионал», 2006. — С. 837—954. — 1464 с. — (Новый справочник химика и технолога / ред. Москвин А. В. ; вып. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии.). — ISBN 978-5-91259-013-9.
- ST/ESA/282: Сводный список товаров, потребление и/или продажа которых запрещены, которые изъяты, строго ограничены или не утверждены правительствами. Лекарственные средства. — восьмое издание. — Нью-Йорк: Организация Объединённых Наций, 2006.
- Allen E., Triantaphillidou S. The Manual of Photograpy. — 10th edition. — 2011.
- Suzuki R. Developing processes : статья // Encyclopedia of twentieth-century photography / Warren L., editor. — New York : Routledge: Tailor & Francis Group LLC, 2006. — Т. Volume 1: A—F Index. — С. 382—389.
Гидрохинон Википедия
| Гидрохинон | |||
|---|---|---|---|
| |||
({{{изображение}}}) | |||
| Систематическое наименование | бензол-1,4-диол | ||
| Хим. формула | C6H6O2 | ||
| Молярная масса | 110,11 г/моль | ||
| Плотность | 1.36 г/см³ | ||
| Энергия ионизации | 7,95 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | 173,8—174,8 °C | ||
| • кипения | 286,5 °C | ||
| • вспышки | 165 °C | ||
| Давление пара | 1,0E-5 ± 0,00001 мм рт.ст.[1] | ||
| Растворимость | |||
| • в воде | 5,26 г/100 мл (5 °С) 21,21 г/100 мл (50 °С) 56,25 г/100 мл (70 °С) | ||
| • в спирте | 127,27 г/100 г | ||
| • в ацетоне | 77,94 г/100 г | ||
| Рег. номер CAS | 123-31-9 | ||
| PubChem | 785 | ||
| Рег. номер EINECS | 204-617-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | MX3500000 | ||
| ChEBI | 17594 | ||
| ChemSpider | 764 | ||
| ЛД50 | 302 мг/кг (крысы, перорально) | ||
| Пиктограммы СГС | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Гидрохино́н (пара-дигидроксибензол, бензол-1,4-диол, хинол) — ароматическое органическое соединение, представитель двуатомных фенолов с химической формулой C6H4(OH)2, изомер пирокатехина и резорцина. Название «гидрохинон» дано соединению Ф. Вёлером из-за схожести свойств с хиноном, из которого Вёлер его синтезировал. Сильный восстановитель, используется как проявитель в фотографии, антиоксидант в химической промышленности, реагент для определения ниобия, вольфрама, золота и цезия в аналитической химии.
Торговое наименование: H-142[2].
История
Ж. Б. Каванту (слева) и П. Ж. Пеллетье (справа), впервые получившие гидрохинон | ||||||||||
Впервые был выделен французскими химиками Пьером Жозефом Пеллетье и Жозефом Бьенеме Каванту при перегонке хинной кислоты в 1820 году. Синтез гидрохинона первым осуществил Фридрих Вёлер в 1844 году восстановлением хинона. Также Вёлер дал ему современное название и описал его свойства[3].
Уильям Эбней в 1880 году обнаружил проявляющие свойства соединения, что привело к разработке способов промышленного синтеза. Дальнейшие опыты с гидрохиноном привели к созданию проявителей с двумя проявляющими веществами. Первый из таких проявителей получил Генри Дж. Ньютон в 1889 году, добавив гидрохинон к эйконогеновому проявителю, и получив итоговый состав, который использовал лучшие свойства обоих проявляющих веществ. Вскоре после этого были предложены метол-гидрохиноновые проявители (обозначающиеся символами MQ в англоязычных источниках), в которых был замечен феномен супераддитивности — эффект, когда проявитель с двумя разными проявляющими веществами работает значительно более активно, чем это должно было быть, если исходить из расчета суммы активности обоих проявляющих веществ. Эффект супераддитивности был подтвержден и обоснован научными работами Левенсона в конце 1940-х годов, который показал, что в таком случае проявление изображения ведется метолом, а роль гидрохинона заключается в регенерации отработанного метола
Открытие Дж. Д. Кендаллом проявляющей способности фенидона в 1940 году привело к созданию еще более эффективной системы фенидон-гидрохиноновых проявителей (PQ в англоязычной литературе). Фенидон мало пригоден для использования в качестве единственного проявляющего вещества, так как дает сильное вуалирование фотоматериала, но в супераддитивных проявителях с гидрохиноном эта особенность исчезает, давая качественное итоговое изображение, значительное ускорение процесса обработки, меньшую токсичность и другие преимущества по сравнению с метол-гидрохиноновыми составами[5][6].
Физические свойства
Белые или бесцветные призматические кристаллы, сладковатые на вкус[7][8]. Имеет модификации, отличающиеся физическими свойствами: стабильная α-модификация имеет температуру плавления 173,8—174,8 °C и плотность 1,36 г/см2, нестабильная γ-модификация — температуру плавления 169 °C и плотность 1,325 г/см2. Имеет молярную массу 110,11 г/моль, температуру кипения 286,5 °C, температуру вспышки 165 °C. Возгоняется при 163,5 °C (10 мм рт. ст.)[8].
Растворим в воде (5,26 г/100 мл при 5 °С, 21,21 г/100 мл при 50 °С, 56,25 г/100 мл при 70 °С), спирте (127,27 г/100 г), ацетоне (77,94 г/100 г). Образует клатраты. В частности, клатрат с метанолом имеет формулу 3C6H6O2·CH3OH[8].
Реактив может содержать примеси, выглядящие как нерастворимый чёрный порошок. Количество примесей возрастает при длительном или неправильном хранении и при их большом количестве реактив становится непригодным к использованию[9].
Химические свойства
Является сильным восстановителем. Процесс взаимодействия с окислителями происходит в два этапа — на первом гидрохинон превращается в хингидрон, на втором — в 4-бензохинон[8].
При взаимодействии с водным раствором карбоната калия при 130 °С превращается в 2,5-дигидроксибензойную кислоту, с метиламином под давлением при 200 °С образует 4-метиламинофенол, с малеиновым ангидридом — нафтазарин, с фталевым ангидридом дает хинизарин. Образует простые моно- и диэфиры при обработке алкилирующими реагентами[8].
Аналитическое определение
Гидрохинон может быть определён при помощи цветных реакций[8]:
Фотографическое проявление
Обладает проявляющими свойствами, восстанавливая бромистое серебро в щелочных растворах с образованием 4-бензохинона и бромоводорода[10] с общим уравнением:
- + 2 AgBr →OH−{\displaystyle {\ce {->[OH^{-}]}}} + 2 Ag + 2 HBr
Проявление начинается при pH выше 9,5[11]. Процесс состоит из нескольких стадий[12]:
- в щелочной среде гидрохинон диссоциирует в дианион гидрохинона[13]:
- ⇌H+OH−{\displaystyle {\ce {<=>[OH^-][H^+]}}} + 2H+
- дианион гидрохинона окисляется на центре проявления с образованием на первой стадии иона семихинона и 4-бензохинона на второй[14]:
- ⇌−e−{\displaystyle {\ce {<=>[-e^-]}}} ⇌−e−{\displaystyle {\ce {<=>[-e^-]}}}
- ионы серебра восстанавливаются до металлического серебра[14]:
- 2Ag+ + 2e—⟶{\displaystyle {\ce {->}}} 2Ag
Получение
Изначально гидрохинон был получен из хинона. Разные варианты данного способа по-прежнему применяют для лабораторного получения реактива; для этого, например, проводят восстановление водного раствора 4-бензохинона, используя диоксид серы[8][15].
В промышленности синтезируют следующими способами[8]:
- окислением 1,4-диизопропилбензола воздухом, затем проводят кислотный гидролиз полученного бис-гидропероксида с образованием гидрохинона и ацетона;
- гидроксилированием фенола 70 % перекисью водорода при 90 °С с использованием в качестве катализаторов 75 % ортофосфорную кислоту или 65 % хлорную кислоту. В результате реакции образуется смесь гидрохинона и пирокатехина, которую в дальнейшем разделяют ректификацией;
- взаимодействием фенола и ацетона с образованием 4-изопропилфенола, который окисляют перекисью водорода в кислой среде с образованием гидрохинона и ацетона;
- окислением сернокислого анилина двуокисью марганца или хромовой кислотой до 4-бензохинона, затем восстанавливают 4-бензохинон порошкообразным железом в воде при 70—80 °С в присутствии гидросульфита натрия с общим выходом реакции 74—84 %.
Технические условия выпуска гидрохинона в СССР и Российской Федерации установлены ГОСТ 19627-74[16]. В соответствии с ним выпускается два сорта реактива — высший и первый. Высший сорт выглядит как белый или серовато-белый порошок и содержит 99,5 % основного вещества, первый — как белый с желтоватым оттенком и содержит 99 % основного вещества[17].
Хотя при промышленном производстве обычно получают достаточно чистый реактив, но при необходимости можно получить большую степень очистки, перекристаллизовав продажный реактив из тщательно обескислороженной воды[18].
Оценка производственных мощностей США по производству гидрохинона составляла порядка 11,3 тыс. тонн в год (по состоянию на 1965 г.)[19].
Применение
Применяется:
Применение в аналитической химии
Используется при[8]:
Применение в фотографии
Как единственное проявляющее вещество обычно применяется только в специальных проявителях, предназначенных для получения высокой оптической плотности, например для целей репродуцирования или полиграфии, либо для получения коричневой окраски на бромосеребряных фотобумагах[17].
Составы с гидрохиноном чувствительны к изменениями температуры: оптимальной является 18 °C, при 19 °C скорость работы нормальная, но уже при 20 °C начинается вуалирование; при снижении температуры до 10 °C проявление практически останавливается и при достижении 5 °C прекращается полностью[17].
Обычно применяется в проявителях вместе с метолом или фенидоном, при этом вуалирующая способность, присущая гидрохинону, исчезает[17].
Правовой статус
По состоянию на 2006 год известно о запрете лекарственных препаратов в Нигерии, содержащих более 5 % гидрохинона, из-за их нецелевого использования, а также о существовании в Германии ограничений на использование препаратов с гидрохиноном, где они могут применяться только для случаев патологической пигментации и не могут применяться для детей и подростков младше 12 лет[20].
Биологическая роль
Обладает слабым дезинфекционным действием, аналогичным тому, который оказывает фенол[8].
Безопасность, охрана труда
В больших количествах токсичен. LD50 составляет 302 мг/кг (крысы, перорально). При попадании в организм окисляется до 4-бензохинона, превращающего гемоглобин в метгемоглобин. Может вызывать поражение глаз — конъюнктивит, и кожи — дерматит. ПДК для аэрозоля составляет 2 мг/м3. Рейтинг NFPA 704: опасность для здоровья: 2, огнеопасность: 1, нестабильность: 1. Подтверждена канцерогенность для животных с неизвестной релевантностью для человека[21][8][2].
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0338.html
- ↑ 1 2 3 Гурлев, 1988, с. 278.
- ↑ 1 2 Стилл, 1976, с. 485.
- ↑ Suzuki, 2006, с. 385.
- ↑ Allen, 2011, с. 257.
- ↑ Suzuki, 2006, с. 385—386.
- ↑ Медведев, 1929.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Карпова, 1988.
- ↑ Гурлев, 1988, с. 279.
- ↑ Редько, 2006, с. 855.
- ↑ Редько, 2006, с. 856.
- ↑ Редько, 2006, с. 863—864.
- ↑ Редько, 2006, с. 863.
- ↑ 1 2 Редько, 2006, с. 864.
- ↑ Прянишников, 1956, с. 112.
- ↑ ГОСТ.
- ↑ 1 2 3 4 Гурлев, 1988, с. 278—279.
- ↑ Стилл, 1976, с. 488.
- ↑ Стилл, 1976, с. 487.
- ↑ 1 2 UN, 2006, с. 116.
- ↑ Fisher Scientific.
Литература
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988. — 335 с. — ISBN 5-335-00125-4.
- Карпова Н. Б. Гидрохинон : статья // Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М. : Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 570. — 623 с.
- Медведев С. Гидрохинон : статья // Техническая энциклопедия / гл. ред. Мартенс Л. К.. — М. : Акционерное общество «Советская энциклопедия», 1929. — Т. 5. — С. 569.
- Мономеры для поликонденсации / под ред. Дж. Стилла, Т. У. Кэмпбелла; пер. с англ. Выгодского Я. С., ред. Коршак В. В. — Мир, 1976.
- Прянишников Н. Д. Практикум по органической химии. — М.: Государственное научно-техническое издательство химической литературы, 1956. — 244 с.
- Редько А. В. Химия фотографических процессов. — СПб. : НПО «Профессионал», 2006. — С. 837—954. — 1464 с. — (Новый справочник химика и технолога / ред. Москвин А. В. ; вып. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии.). — ISBN 978-5-91259-013-9.
- ST/ESA/282: Сводный список товаров, потребление и/или продажа которых запрещены, которые изъяты, строго ограничены или не утверждены правительствами. Лекарственные средства. — восьмое издание. — Нью-Йорк: Организация Объединённых Наций, 2006.
- Allen E., Triantaphillidou S. The Manual of Photograpy. — 10th edition. — 2011.
- Suzuki R. Developing processes : статья // Encyclopedia of twentieth-century photography / Warren L., editor. — New York : Routledge: Tailor & Francis Group LLC, 2006. — Т. Volume 1: A—F Index. — С. 382—389.
Ссылки
ГИДРОХИНОН — это… Что такое ГИДРОХИНОН?
гидрохинон — гидрохинон … Орфографический словарь-справочник
ГИДРОХИНОН — в медиц. и фотографии раствор хинона (бесцветн. кристаллы из коры хинного дерева) с сернистой кислотой. Полный словарь иностранных слов, вошедших в употребление в русском языке. Попов М., 1907. ГИДРОХИНОН вещество, получаемое от действия серной… … Словарь иностранных слов русского языка
Гидрохинон — Общие Химическая формула C … Википедия
ГИДРОХИНОН — (пара дигидроксибензол) C6h5(OH)2, светло серые кристаллы, tпл 174 .C. Промежуточный продукт в производстве красителей, проявляющее вещество в фотографии, антиоксидант, ингибитор полимеризации … Большой Энциклопедический словарь
гидрохинон — сущ., кол во синонимов: 2 • проявитель (9) • хинон (31) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
гидрохинон — (пара дигидроксибензол), светло серые кристаллы, tпл 170ºC. Промежуточный продукт в производстве красителей, проявляющее вещество в фотографии, антиоксидант, ингибитор полимеризации. * * * ГИДРОХИНОН ГИДРОХИНОН (пара дигидроксибензол), C6h5(OH)2 … Энциклопедический словарь
Гидрохинон — С6Н4(ОН)2 двуатомный фенол, парадиоксибензол. Впервые получен в нечистом состоянии Пеллетье и Каванту при сухой перегонке хинной кислоты, подробно изучен Вёлером в 1844 г. Найден в некоторых растениях, образуется при распадении глюкозида арбутина … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
гидрохинон — hidrochinonas statusas T sritis chemija formulė C₆H₄(OH)₂ atitikmenys: angl. hydroquinone rus. гидрохинон ryšiai: sinonimas – 1,4 benzendiolis … Chemijos terminų aiškinamasis žodynas
Гидрохинон — n диоксибензол, бесцветные кристаллы, tпл 170,3 °С; плотность 1,358 г/см2; возгоняется в вакууме. Г. хорошо растворим в спирте, эфире, плохо в бензоле; 5,7 г Г. растворяется в 100 г воды при15 °С. Г. сильный… … Большая советская энциклопедия
гидрохинон — гидрохинон, гидрохиноны, гидрохинона, гидрохинонов, гидрохинону, гидрохинонам, гидрохинон, гидрохиноны, гидрохиноном, гидрохинонами, гидрохиноне, гидрохинонах (Источник: «Полная акцентуированная парадигма по А. А. Зализняку») … Формы слов
Гидрохинон — это… Что такое Гидрохинон?
С6Н4(ОН)2 — двуатомный фенол, парадиоксибензол. Впервые получен в нечистом состоянии Пеллетье и Каванту при сухой перегонке хинной кислоты, подробно изучен Вёлером в 1844 г. Найден в некоторых растениях, образуется при распадении глюкозида арбутина под влиянием эмульсина, синтетически получен из парайодофенола и парадиазофенола. Обыкновенный способ получения — восстановление хинона: к раствору анилина в серной кислоте прибавляется двухромокалиевая соль и образовавшийся окислением анилина хинон восстановляется сернистым газом, пропускаемым в раствор. Профильтрованный раствор извлекается эфиром. При испарении эфирной вытяжки остается Г., который очищается кристаллизацией из кипящего толуола. Г. диморфен: из водного раствора кристаллизуется в прочной форме в виде гексагональных призм, при возгонке — в непрочной, в виде одноклиномерных пластинок. Плав. при 177°, легко растворим в воде, спирте, эфире. Окисляющими веществами, напр. хлором, азотной, хромовой кислотами, азотно-серебряной солью, хлорным железом и проч. переводится в хинон; поэтому в отличие от своих изомеров, резорцина и пирокатехина, не дает окрашивания с хлорным железом, восстановляет Фелингову жидкость. В водном растворе в присутствии платиновой черни или угля, окисляется кислородом воздуха в хингидрон или зеленый гидрохинон, соединение Г. с хиноном, крист. в зеленых с металлическим отливом иголочках. С фталевым ангидридом Г. образует фталеин и хинизарин, крист. в красных иголочках и пластинках, изомерный и весьма сходный с ализарином. Водный раствор Г. с поташом или содой и средней сернистой натровой солью употребляется в фотографии, как прекрасный проявитель для инсолированных броможелатинных пластинок.
В. Е. Тищенко. Δ.
Г. в медицине употребляется как противолихорадное средство; 0,5 грамма значительно понижают температуру у больного лихорадкой. Дозы от 0,3 до 1,0 несколько раз в день; водный 10% раствор применяется для подкожных впрыскиваний, которые совершенно безболезненны. Впрочем, врачи употребляют Г. сравнительно редко, вследствие того, что у некоторых лиц он оказывает побочное действие на нервную систему, преимущественно на головной и спинной мозг, вызывая головокружение, судороги.
А. Л—ий.
Гидрохинон в косметике: польза или вред?
Содержание статьи
Гидрохинон – это вещество, которое входит в состав многих кремов отличающихся отбеливающим эффектом. Средства с гидрохиноном делают вашу кожу более светлой, при этом мало кому известно, что они еще являются и токсичными. Давайте постараемся узнать как можно больше информацию, про крем с гидрохиноном, насколько он вреден и какие последствия могут быть от его использования.
Использование гидрохинона в косметике и его свойства

В большинстве случаев это вещество содержится в продуктах, направленных на осветление кожи, в это же время, крем с гидрохиноном от пигментных пятен представляет собой одно из наиболее токсичных веществ, которое и по сегодняшний день применяется в косметологии.
Наибольшей популярностью крем с гидрохиноном для лица пользуется среди обладательниц темной кожей, которые склонны к использованию различных продуктов, направленных на осветление кожи.
В большинстве случаев, те люди, которые пользуются различными косметическими средствами, в основе которых находится этот компонент, также могут пользоваться и другими ингредиентами, отличающимися высоким уровнем токсичности.
Средства с гидрохиноном – это не только крема, но также гели для волос, лаки для ногтей, краски для волос, а также средства способствующие выпрямлению локонов.
На сегодняшний день было проведено огромное количество всевозможных исследований о том, какое в общем воздействие на здоровье человека способны оказать химические вещества. Среди всех уже завершенных исследований, было сказано о серьезном увеличении суммарного негативного воздействия от использования косметических средств на основе этого вещества.
Кроме его прямого назначения осветлять кожу, существуют крема с гидрохиноном отбеливающие, средства для очищения лица, кондиционеры для волос, увлажняющие крема и многое остальное.
Данный компонент являлся примесью токоферола ацетата в 24.9 процентах случаев, а также в 12.1 % средств содержащих токоферол линолеатом и остальные составляющие имеющие корень «токо». Все они находятся в базе данных Skin Deep рабочей экологической группа.
Влияние гидрохинона на состояние кожи

Крем с гидрохиноном для лица может стать причиной возникновения злокачественных образований, особенно это касается рака кожи, так как он делает ее абсолютно беззащитной перед лучами ультрафиолета.
Средства с гидрохиноном завоевали такую плохую репутацию по причине того, что проведенные исследования показали, что в этом веществе содержатся определенные канцерогенные эффекты, при нанесении которых на кожу, они становятся цитотоксическими (вредными и токсичными для клеток, оказывая на них мутагенные свойства).
Кроме этого, также удалось доказать и то, что такие вещества способствуют возникновению пигментации глаз, а также повреждению роговицы. Происходит это только по той причине, когда глаз подвергается напрямую негативному воздействию гидрохинона. Именно по этой причине рекомендуется остерегаться даже незначительного попадания в глаза косметики содержащей в своем составе это вещество.
Крем с гидрохиноном может стать причиной возникновения охроноза – заболевания, которое проявляется потемнением цвета кожи (либо изменением ее цвета – оттенок может меняться и становиться приближенным к серому либо даже голубому), а еще прогрессирующем разрушением коллагеновых и эластиновых волокон. Такое заболевание при этом встречается крайне редко среди американок либо европеек, однако для жительниц африканских стран оно превратилось в настоящую проблему.
Применение средств содержащих данный компонент считается контропродуктивным. Вы желаете получить сияющую, святящуюся и здоровую кожу, однако в результате продолжительного применения таких кремов это может привести лишь к тому, что вы получите обратный результат. В итоге использования кремов вы получите: очень темные лодыжки и суставы, неравномерный цвет кожного покрова, а также венозный неприглядный рисунок.
Какой еще способен оказать гидрохинон вред для кожи? В результате использования средств с этим веществом может возникнуть контактный дерматит и раздражение, кроме того в разы увеличивается вероятность возникновения остальных видов кожных раздражений, которые могут проявиться в качестве покраснения и сильного зуда.
Многие продукты, содержащие в своем составе это вещество, отличаются наличием сильного неприятного запаха и приводят к повышенному потоотделению. Нередко, пользователи таких косметических средств стараются избавиться от неприятного запаха используя большое количество парфюмерных средств, что способствует только еще большему усугублению ситуации.
Гидрохинон, применение в медицине которого запрещено, в составе косметических средств приводит к тому, что наружный слой кожи становится еще более тонким, в результате этого хуже заживают швы, порезы и раны.
Отбеливающие составляющие косметических средств могут привести к тому, что на коже ускоряется процесс старения, она становится более морщинистой в следствии потери своей упругости.
Сочетание гидрохинона в тех средствах, которые кроме этого имеют в своем составе перекись водорода или перекись бензоила (а также другие разновидности перекиси, в большей степени, предназначенные для лечения акне) способны причинить явный вред коже.
Такие крема с гидрохиноном отбеливающие способны стать причиной окрашивания кожи. Кроме того, использовать такой компонент категорически запрещено с любыми процедурами, направленными на осветление кожи, имеющими в своей основе резорцин.
Безопасные заменители гидрохинона в составе косметики

Если вы все же мечтаете получить более светлый оттенок кожи, то мы рекомендуем обратиться к средствам, являющимся заменителями гидрохинона, но не оказывающим на кожу такое негативное воздействие.
Среди менее вредных, но в это же время не менее эффективных средств можно выделить витамин С, арбутин, азелаиновую кислоту и многое остальное. Итак, чем можно заменить крем с гидрохиноном от пятен на коже:
- шелковица, толокнянка, клюква – продукты, содержащие большое количество арбутина, натурального продукта, направленного на снижение уровня меланина в коже;
- витамин Е и А, и особенно витамин С. С их помощью ваша кожа приобретет яркий и сияющий вид, причем без каких либо негативных последствий. Они сводят к минимуму вероятность возникновения морщин, пигментных пятен, увеличивают эластичность и упругость кожи;
- средство для отбеливания кожи Lumixyl – это недавняя разработка от исследователей Стэнфордского университета. В результате многочисленных тестирований оно было признанно эффективным в лечении меланодермии, а также коричневых пятен на коже любого происхождения. Принцип его действия и результаты схожи с гидрохиноном, при этом Lumixyl не обладает токсичностью;
- кислота азелаиновая – ее высокое содержание можно встретить во ржи, ячмене и пшенице. Это известный многим антиоксидант, который оказывает на состояние кожи положительное воздействие, в том числе и делая ее более светлой.
В целом, врачи рекомендуют прибегать к отбеливанию кожи только в крайних ситуациях, в том случае, если на ней заметны серьезные дефекты, ухудшающие ее эстетический вид. В том же случае, если вы хотите попросту сделать вашу кожу более светлой, то лучше хорошо подумать перед началом процедуры.
Многие женщины во всем мире только мечтают получить такую кожу как у вас. Оставайтесь такой, какая вы есть, ведь именно натуральная красота на сегодняшний день цениться выше всего. А также не забывайте о серьезных последствиях, которые могут произойти после использования кремов с гидрохиноном для осветления кожи.
Гидрохинон — Википедия. Что такое Гидрохинон
| Гидрохинон | |
 | |
  | |
| Общие | |
|---|---|
| Систематическое наименование | бензол-1,4-диол |
| Хим. формула | C6H6O2 |
| Физические свойства | |
| Молярная масса | 110,11 г/моль |
| Плотность | 1.36 г/см³ |
| Энергия ионизации | 7,95 ± 0,01 эВ[1] |
| Термические свойства | |
| Т. плав. | 173,8—174,8 °C |
| Т. кип. | 286,5 °C |
| Т. всп. | 165 °C |
| Давление пара | 1,0E-5 ± 1,0E-5 мм рт.ст.[1] |
| Химические свойства | |
| Растворимость в воде | 5,26 г/100 мл (5 °С) 21,21 г/100 мл (50 °С) 56,25 г/100 мл (70 °С) |
| Растворимость в спирте | 127,27 г/100 г |
| Растворимость в ацетоне | 77,94 г/100 г |
| Классификация | |
| Рег. номер CAS | 123-31-9 |
| PubChem | 785 |
| Рег. номер EINECS | 204-617-8 |
| SMILES | |
| InChI | |
| RTECS | MX3500000 |
| ChEBI | 17594 |
| ChemSpider | 764 |
| Безопасность | |
| ЛД50 | 302 мг/кг (крысы, перорально) |
| Пиктограммы СГС |     |
| NFPA 704 |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гидрохино́н (пара-дигидроксибензол, бензол-1,4-диол, хинол) — ароматическое органическое соединение, представитель двуатомных фенолов с химической формулой C6H4(OH)2, изомер пирокатехина и резорцина. Название «гидрохинон» дано соединению Ф. Вёлером из-за схожести свойств с хиноном, из которого Вёлер его синтезировал. Сильный восстановитель, используется как проявитель в фотографии, антиоксидант в химической промышленности, реагент для определения ниобия, вольфрама, золота и цезия в аналитической химии.
Торговое наименование: H-142[2].
История
 | ||||||||||
Ж. Б. Каванту (слева) и П. Ж. Пеллетье (справа), впервые получившие гидрохинон | ||||||||||
Впервые был выделен французскими химиками Пьером Жозефом Пеллетье и Жозефом Бьенеме Каванту при перегонке хинной кислоты в 1820 году. Синтез гидрохинона первым осуществил Фридрих Вёлер в 1844 году восстановлением хинона. Также Вёлер дал ему современное название и описал его свойства[3].
Уильям Эбней в 1880 году обнаружил проявляющие свойства соединения, что привело к разработке способов промышленного синтеза. Дальнейшие опыты с гидрохиноном привели к созданию проявителей с двумя проявляющими веществами. Первый из таких проявителей получил Генри Дж. Ньютон в 1889 году, добавив гидрохинон к эйконогеновому проявителю, и получив итоговый состав, который использовал лучшие свойства обоих проявляющих веществ. Вскоре после этого были предложены метол-гидрохиноновые проявители (обозначающиеся символами MQ в англоязычных источниках), в которых был замечен феномен супераддитивности — эффект, когда проявитель с двумя разными проявляющими веществами работает значительно более активно, чем это должно было быть, если исходить из расчета суммы активности обоих проявляющих веществ. Эффект супераддитивности был подтвержден и обоснован научными работами Левенсона в конце 1940-х годов, который показал, что в таком случае проявление изображения ведется метолом, а роль гидрохинона заключается в регенерации отработанного метола[4][3].
Открытие Дж. Д. Кендаллом проявляющей способности фенидона в 1940 году привело к созданию еще более эффективной системы фенидон-гидрохиноновых проявителей (PQ в англоязычной литературе). Фенидон мало пригоден для использования в качестве единственного проявляющего вещества, так как дает сильное вуалирование фотоматериала, но в супераддитивных проявителях с гидрохиноном эта особенность исчезает, давая качественное итоговое изображение, значительное ускорение процесса обработки, меньшую токсичность и другие преимущества по сравнению с метол-гидрохиноновыми составами[5][6].
Физические свойства
Белые или бесцветные призматические кристаллы, сладковатые на вкус[7][8]. Имеет модификации, отличающиеся физическими свойствами: стабильная α-модификация имеет температуру плавления 173,8—174,8 °C и плотность 1,36 г/см2, нестабильная γ-модификация — температуру плавления 169 °C и плотность 1,325 г/см2. Имеет молярную массу 110,11 г/моль, температуру кипения 286,5 °C, температуру вспышки 165 °C. Возгоняется при 163,5 °C (10 мм рт. ст.)[8].
Растворим в воде (5,26 г/100 мл при 5 °С, 21,21 г/100 мл при 50 °С, 56,25 г/100 мл при 70 °С), спирте (127,27 г/100 г), ацетоне (77,94 г/100 г). Образует клатраты. В частности, клатрат с метанолом имеет формулу 3C6H6O2·CH3OH[8].
Реактив может содержать примеси, выглядящие как нерастворимый чёрный порошок. Количество примесей возрастает при длительном или неправильном хранении и при их большом количестве реактив становится непригодным к использованию[9].
Химические свойства
Является сильным восстановителем. Процесс взаимодействия с окислителями происходит в два этапа — на первом гидрохинон превращается в хингидрон, на втором — в 4-бензохинон[8].
При взаимодействии с водным раствором карбоната калия при 130 °С превращается в 2,5-дигидроксибензойную кислоту, с метиламином под давлением при 200 °С образует 4-метиламинофенол, с малеиновым ангидридом — нафтазарин, с фталевым ангидридом дает хинизарин. Образует простые моно- и диэфиры при обработке алкилирующими реагентами[8].
Аналитическое определение
Гидрохинон может быть определён при помощи цветных реакций[8]:
Фотографическое проявление
Обладает проявляющими свойствами, восстанавливая бромистое серебро в щелочных растворах с образованием 4-бензохинона и бромоводорода[10] с общим уравнением:
 + 2 AgBr →OH−{\displaystyle {{\ce {->[OH^{-}]}}}}
+ 2 AgBr →OH−{\displaystyle {{\ce {->[OH^{-}]}}}}  + 2 Ag + 2 HBr
+ 2 Ag + 2 HBr
Проявление начинается при pH выше 9,5[11]. Процесс состоит из нескольких стадий[12]:
- в щелочной среде гидрохинон диссоциирует в дианион гидрохинона[13]:
 ⇌H+OH−{\displaystyle {\ce {<=>[OH^-][H^+]}}}
⇌H+OH−{\displaystyle {\ce {<=>[OH^-][H^+]}}}  + 2H+
+ 2H+
- дианион гидрохинона окисляется на центре проявления с образованием на первой стадии иона семихинона и 4-бензохинона на второй[14]:
 ⇌−e−{\displaystyle {\ce {<=>[-e^-]}}}
⇌−e−{\displaystyle {\ce {<=>[-e^-]}}}  ⇌−e−{\displaystyle {\ce {<=>[-e^-]}}}
⇌−e−{\displaystyle {\ce {<=>[-e^-]}}} 
- ионы серебра восстанавливаются до металлического серебра[14]:
- 2Ag+ + 2e—⟶{\displaystyle {\ce {->}}} 2Ag
Получение
Изначально гидрохинон был получен из хинона. Разные варианты данного способа по-прежнему применяют для лабораторного получения реактива; для этого, например, проводят восстановление водного раствора 4-бензохинона используя диоксид серы[8][15].
В промышленности синтезируют следующими способами[8]:
- окислением 1,4-диизопропилбензола воздухом, затем проводят кислотный гидролиз полученного бис-гидропероксида с образованием гидрохинона и ацетона;
- гидроксилированием фенола 70 % перекисью водорода при 90 °С с использованием в качестве катализаторов 75 % ортофосфорную кислоту или 65 % хлорную кислоту. В результате реакции образуется смесь гидрохинона и пирокатехина, которую в дальнейшем разделяют ректификацией;
- взаимодействием фенола и ацетона с образованием 4-изопропилфенола, который окисляют перекисью водорода в кислой среде с образованием гидрохинона и ацетона;
- окислением сернокислого анилина двуокисью марганца или хромовой кислотой до 4-бензохинона, затем восстанавливают 4-бензохинон порошкообразным железом в воде при 70—80 °С в присутствии гидросульфита натрия с общим выходом реакции 74—84 %.
Технические условия выпуска гидрохинона в СССР и Российской Федерации установлены ГОСТ 19627-74[16]. В соответствии с ним выпускается два сорта реактива — высший и первый. Высший сорт выглядит как белый или серовато-белый порошок и содержит 99,5 % основного вещества, первый — как белый с желтоватым оттенком и содержит 99 % основного вещества[17].
Хотя при промышленном производстве обычно получают достаточно чистый реактив, но при необходимости можно получить большую степень очистки, перекристаллизовав продажный реактив из тщательно обескислороженной воды[18].
Оценка производственных мощностей США по производству гидрохинона составляла порядка 11,3 тыс. тонн в год (по состоянию на 1965 г.)[19].
Применение
Применяется:
Применение в аналитической химии
Используется при[8]:
Применение в фотографии
Как единственное проявляющее вещество обычно применяется только в специальных проявителях, предназначенных для получения высокой оптической плотности, например для целей репродуцирования или полиграфии, либо для получения коричневой окраски на бромосеребряных фотобумагах[17].
Составы с гидрохиноном чувствительны к изменениями температуры: оптимальной является 18 °C, при 19 °C скорость работы нормальная, но уже при 20 °C начинается вуалирование; при снижении температуры до 10 °C проявление практически останавливается и при достижении 5 °C прекращается полностью[17].
Обычно применяется в проявителях вместе с метолом или фенидоном, при этом вуалирующая способность, присущая гидрохинону, исчезает[17].
Правовой статус
По состоянию на 2006 год известно о запрете лекарственных препаратов в Нигерии, содержащих более 5 % гидрохинона из-за их нецелевого использования, а также о существовании в Германии ограничений на использование препаратов с гидрохиноном, где они могут применяться только для случаев патологической пигментации и не могут применяться для детей и подростков младше 12 лет[20].
Биологическая роль
Обладает слабым дезинфекционным действием, аналогичным тому, который оказывает фенол[8].
Безопасность
Токсичен. LD50 составляет 302 мг/кг (крысы, перорально). При попадании в организм окисляется до 4-бензохинона, превращающего гемоглобин в метгемоглобин. Может вызывать поражение глаз — конъюнктивит, и кожи — дерматит. ПДК для аэрозоля составляет 2 мг/м3. Рейтинг NFPA 704: опасность для здоровья: 2, огнеопасность: 1, нестабильность: 1. Подтверждена канцерогенность для животных с неизвестной релевантностью для человека[21][8][2].
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0338.html
- ↑ 1 2 3 Гурлев, 1988, с. 278.
- ↑ 1 2 Стилл, 1976, с. 485.
- ↑ Suzuki, 2006, с. 385.
- ↑ Allen, 2011, с. 257.
- ↑ Suzuki, 2006, с. 385—386.
- ↑ Медведев, 1929.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Карпова, 1988.
- ↑ Гурлев, 1988, с. 279.
- ↑ Редько, 2006, с. 855.
- ↑ Редько, 2006, с. 856.
- ↑ Редько, 2006, с. 863—864.
- ↑ Редько, 2006, с. 863.
- ↑ 1 2 Редько, 2006, с. 864.
- ↑ Прянишников, 1956, с. 112.
- ↑ ГОСТ.
- ↑ 1 2 3 4 Гурлев, 1988, с. 278—279.
- ↑ Стилл, 1976, с. 488.
- ↑ Стилл, 1976, с. 487.
- ↑ 1 2 UN, 2006, с. 116.
- ↑ Fisher Scientific.
Литература
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988. — 335 с. — ISBN 5-335-00125-4.
- Карпова Н. Б. Гидрохинон : статья // Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М. : Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 570. — 623 с.
- Медведев С. Гидрохинон : статья // Техническая энциклопедия / гл. ред. Мартенс Л. К.. — М. : Акционерное общество «Советская энциклопедия», 1929. — Т. 5. — С. 569.
- Мономеры для поликонденсации / под ред. Дж. Стилла, Т. У. Кэмпбелла; пер. с англ. Выгодского Я. С., ред. Коршак В. В. — Мир, 1976.
- Прянишников Н. Д. Практикум по органической химии. — М.: Государственное научно-техническое издательство химической литературы, 1956. — 244 с.
- Редько А. В. Химия фотографических процессов. — СПб. : НПО «Профессионал», 2006. — С. 837—954. — 1464 с. — (Новый справочник химика и технолога / ред. Москвин А. В. ; вып. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии.). — ISBN 978-5-91259-013-9.
- ST/ESA/282: Сводный список товаров, потребление и/или продажа которых запрещены, которые изъяты, строго ограничены или не утверждены правительствами. Лекарственные средства. — восьмое издание. — Нью-Йорк: Организация Объединённых Наций, 2006.
- Allen E., Triantaphillidou S. The Manual of Photograpy. — 10th edition. — 2011.
- Suzuki R. Developing processes : статья // Encyclopedia of twentieth-century photography / Warren L., editor. — New York : Routledge: Tailor & Francis Group LLC, 2006. — Т. Volume 1: A—F Index. — С. 382—389.
Ссылки
Гидрохинон — это… Что такое Гидрохинон?
гидрохинон — гидрохинон … Орфографический словарь-справочник
ГИДРОХИНОН — в медиц. и фотографии раствор хинона (бесцветн. кристаллы из коры хинного дерева) с сернистой кислотой. Полный словарь иностранных слов, вошедших в употребление в русском языке. Попов М., 1907. ГИДРОХИНОН вещество, получаемое от действия серной… … Словарь иностранных слов русского языка
Гидрохинон — Общие Химическая формула C … Википедия
ГИДРОХИНОН — ГИДРОХИНОН, пара диоксибензол, СвН4(ОН)2(1, 4), призматические бесцветные кристаллы, с t° плавления 169 170°, растворимы в воде (1 : 17), еще легче в спирте и эфире. Щелочной раствор Г. жадно поглощает О, на чем основано его применение в… … Большая медицинская энциклопедия
ГИДРОХИНОН — (пара дигидроксибензол) C6h5(OH)2, светло серые кристаллы, tпл 174 .C. Промежуточный продукт в производстве красителей, проявляющее вещество в фотографии, антиоксидант, ингибитор полимеризации … Большой Энциклопедический словарь
гидрохинон — сущ., кол во синонимов: 2 • проявитель (9) • хинон (31) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
гидрохинон — (пара дигидроксибензол), светло серые кристаллы, tпл 170ºC. Промежуточный продукт в производстве красителей, проявляющее вещество в фотографии, антиоксидант, ингибитор полимеризации. * * * ГИДРОХИНОН ГИДРОХИНОН (пара дигидроксибензол), C6h5(OH)2 … Энциклопедический словарь
Гидрохинон — С6Н4(ОН)2 двуатомный фенол, парадиоксибензол. Впервые получен в нечистом состоянии Пеллетье и Каванту при сухой перегонке хинной кислоты, подробно изучен Вёлером в 1844 г. Найден в некоторых растениях, образуется при распадении глюкозида арбутина … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
гидрохинон — hidrochinonas statusas T sritis chemija formulė C₆H₄(OH)₂ atitikmenys: angl. hydroquinone rus. гидрохинон ryšiai: sinonimas – 1,4 benzendiolis … Chemijos terminų aiškinamasis žodynas
гидрохинон — гидрохинон, гидрохиноны, гидрохинона, гидрохинонов, гидрохинону, гидрохинонам, гидрохинон, гидрохиноны, гидрохиноном, гидрохинонами, гидрохиноне, гидрохинонах (Источник: «Полная акцентуированная парадигма по А. А. Зализняку») … Формы слов


 (
( + 2 AgBr →OH−{\displaystyle {\ce {->[OH^{-}]}}}
+ 2 AgBr →OH−{\displaystyle {\ce {->[OH^{-}]}}}  + 2 Ag + 2 HBr
+ 2 Ag + 2 HBr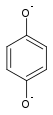 + 2H+
+ 2H+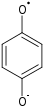 ⇌−e−{\displaystyle {\ce {<=>[-e^-]}}}
⇌−e−{\displaystyle {\ce {<=>[-e^-]}}} 