Гликолевая кислота википедия: Гликолевая кислота — Википедия – Glycolic acid — Wikipedia
Оксикислоты — Википедия
Материал из Википедии — свободной энциклопедии
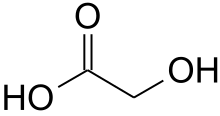
Оксикисло́ты (оксикарбоновые кислоты или гидроксикислоты) — карбоновые кислоты, в которых одновременно содержатся карбоксильная и гидроксильная группы, например молочная кислота: СН3-СН(ОН)-СООН. Оксикислоты проявляют все свойства, характерные для кислот (диссоциация, образование солей, сложных эфиров и т. д.), и свойства, характерные для спиртов (окисление, образование простых эфиров и т. д.).
Оксикислоты весьма широко распространены в природе. Так, к оксикислотам относятся винная, лимонная, яблочная, молочная и некоторые другие природные кислоты, а их название отражает первичный природный источник, в котором было найдено данное вещество.
- Получение α-оксикислот гидролизом оксинитрилов (циангидринов)
- Получение α-оксикислот гидролизом галогенкарбоновых кислот
- Получение β-оксикислот гидратацией непредельных кислот
- Получение β-оксикислот по реакции Реформатского
- Получение β-оксикислот ферментативным окислением предельных кислот в β-положение
- δ- и γ-оксикислоты получают окислением циклических кетонов надкислотами (реакция Байера — Виллигера) с последующим гидролизом лактонов.
Реакция Реформатского[править | править код]
Реакция Реформатского является методом синтеза эфиров β-гидроксикарбоновых кислот.
Гидроксикислоты — химически активные вещества. Наличие в составе их молекул двух видов функциональных групп (-СООН и -ОН) позволяет им легко вступать в различные химические реакции, характерные для карбоновых кислот, спиртов, и типичные для самих гидроксикислот.
Реакции окисления спиртовых групп[править | править код]
Гидроксикислоты легко вступают в реакции окисления спиртовых групп, что обуславливает образование оксокислот — альдегидо- и кетокислот. Например, молочная кислота, окисляясь, превращается в пировиноградную:
- Ch4CH(OH)COOH+[O]→KMnO4+h3OCh4COCOOH+h3O.{\displaystyle {\mathsf {CH_{3}CH(OH)COOH+[O]{\xrightarrow {KMnO_{4}+H_{2}O}}CH_{3}COCOOH+H_{2}O}}.}
Окисление оксикислот при нагревании с концентрированными минеральными кислотами[править | править код]
При нагревании с концентрированной серной кислотой лимонная кислота сначала разлагается на муравьиную и ацетондикарбоновую кислоты:
- HOOCCh3C(OH)COOHCh3COOH→t,h3SO4HCOOH+HOOCCh3COCh3COOH.{\displaystyle {\mathsf {HOOCCH_{2}C(OH)COOHCH_{2}COOH{\xrightarrow {t,H_{2}SO_{4}}}HCOOH+HOOCCH_{2}COCH_{2}COOH}}.}
В подобную реакцию вступает и молочная кислота:
- Ch4CH(OH)COOH→t,h3SO4HCOOH+Ch4CHO.{\displaystyle {\mathsf {CH_{3}CH(OH)COOH{\xrightarrow {t,H_{2}SO_{4}}}HCOOH+CH_{3}CHO}}.}
В результате окисления образуется муравьиная кислота и ацетальдегид.
Образование солей[править | править код]
Оксикислоты реагируют с гидроксидами или солями металлов, образуя кислые или средние соли.
Например, образование кислой и средней солей тартратной кислоты происходит следующим образом.
На первой стадии образуется кислая соль тартратной кислоты, которая практически не растворяется в воде:
- HOOCCH(OH)CH(OH)COOH+KOH→HOOCCH(OH)CH(OH)COOK+h3O.{\displaystyle {\mathsf {HOOCCH(OH)CH(OH)COOH+KOH\rightarrow HOOCCH(OH)CH(OH)COOK+H_{2}O}}.}
На второй стадии образуется средняя соль, которая хорошо растворяется в воде:
- HOOCCH(OH)CH(OH)COOK+KOH→KOOCCH(OH)CH(OH)COOK+h3O.{\displaystyle {\mathsf {HOOCCH(OH)CH(OH)COOK+KOH\rightarrow KOOCCH(OH)CH(OH)COOK+H_{2}O}}.}
При взаимодействии молочной кислоты и гидроксида цинка образуется лактат цинка:
- 2Ch4CH(OH)COOH+Zn(OH)2→(Ch4CH(OH)COO)2Zn+2h3O.{\displaystyle {\mathsf {2CH_{3}CH(OH)COOH+Zn(OH)_{2}\rightarrow (CH_{3}CH(OH)COO)_{2}Zn+2H_{2}O}}.}
Лимонная кислота реагирует с хлоридом кальция образуя цитрат кальция:
- 2HOOCCh3C(OH)COOHCh3COOH+3CaCl2→[OOCCh3C(OH)COOCh3COO]2Ca3+6HCl.{\displaystyle {\mathsf {2HOOCCH_{2}C(OH)COOHCH_{2}COOH+3CaCl_{2}\rightarrow [OOCCH_{2}C(OH)COOCH_{2}COO]_{2}Ca_{3}+6HCl}}.}
Многие оксикислоты получили применение в косметике в качестве кератолитиков[1]. Название, правда, маркетологи немного изменили — для большей привлекательности в косметологии их часто называют «фруктовые кислоты».
- Нейланд О. Я. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз.
- Тюкавкина Н. А. Биоорганическая химия. 2004.
Гликоли — Википедия
Материал из Википедии — свободной энциклопедии
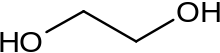
Глико́ли (дио́лы, двухатомные спирты) — класс органических соединений, содержащих в молекуле две гидроксильные группы. Имеют общую формулу CnH2n(OH)2. Простейшим гликолем является этиленгликоль НО−СН2−СН2−ОН.
Названия гликолей образованы от названий соответствующих углеводородов с суффиксами -диол или -гликоль:
- HO−Ch3−Ch3−OH{\displaystyle {\ce {HO-Ch3-Ch3-OH}}} — 1,2-этандиол, этиленгликоль,
- HO−Ch3−Ch3−Ch3−OH{\displaystyle {\ce {HO-Ch3-Ch3-Ch3-OH}}} — 1,3-пропандиол, 1,3-пропиленгликоль.
Низшие гликоли представляют собой бесцветные прозрачные жидкости со сладковатым вкусом. Безводные гликоли гигроскопичны. Из-за наличия двух полярных OH-групп в молекулах гликолей у них высокие вязкость, плотность, температуры плавления и кипения.
Низшие гликоли хорошо растворяются в воде и органических растворителях (спиртах, кетонах, кислотах и аминах). В то же время гликоли сами являются хорошими растворителями для многих веществ, за исключением ароматических и высших предельных углеводородов
Гликоли обладают всеми свойствами спиртов (образуют алкоголяты, простые и сложные эфиры), при этом гидроксильные группы реагируют независимо друг от друга, образовывая смесь продуктов.
С альдегидами и кетонами гликоли образуют 1,3-диоксоланы и 1,3-диоксаны.
- гидролиз соответствующих дихлоралканов
- Cl−Ch3−Ch3−Cl→200 ∘C, 10 MPaNa2CO3HO−Ch3−Ch3−OH,{\displaystyle {\ce {Cl-Ch3-Ch3-Cl->[{\ce {Na2CO3}}][200~^{\circ }{\text{C, 10 MPa}}]HO-Ch3-Ch3-OH,}}}
- окисление алкенов перманганатом калия,
- гидратация оксиранов (эпоксидов).
Гликоли служат в качестве растворителей и пластификаторов. Этиленгликоль и пропиленгликоль используются в качестве антифриза и гидравлических жидкостей. Благодаря высокой температуре кипения (например, 285 °C у триэтиленгликоля), гликоли нашли применение в качестве тормозной жидкости. Гликоли применяются для получения различных эфиров, полиуретанов и др.
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл — Дар). — 623 с.
Гликольальдегид — Википедия
Материал из Википедии — свободной энциклопедии
Гликольальдегид (гидроксиэтаналь, гидроксиуксусный альдегид, гликолевый альдегид) — моносахарид из группы диоз с эмпирической формулой C2H4O2, принадлежит к альдозам.[1] Является простейшим представителем альдосахаров (альдоз) и единственным представителем группы диоз.[2]
Гликольальдегид не имеет асимметричного атома углерода (хирального центра), поэтому стереоизомеры отсутствуют. В кристаллическом состоянии гликольальдегид существует в виде циклического димера, который при растворении в воде распадается на мономерные молекулы.[2]
Гликольальдегид представляет собой сладкое бесцветное кристаллическое вещество, весьма гигроскопичное. В воде хорошо растворим с образованием вязкого сиропа; растворим в горячем этаноле; малорастворим в диэтиловом эфире и жидком аммиаке; практически нерастворим в неполярных органических растворителях. Водный раствор оптической активностью не обладает.[3]
Гликольальдегид вступает практически во все реакции типичные для альдегидов, в том числе дает качественную реакцию на альдегиды с фуксинсернистой кислотой. Подобно альдегидам, он восстанавливает аммиачный раствор оксида серебра(I) с образованием металлического серебра, а также фелингову жидкость с образованием красного оксида меди(I).
Присоединяет синильную кислоту, образуя нитрилы. С фенилгидразином гликольальдегид легко образует фенилгидразон с выделением воды.
Гликольальдегид легко восстанавливается до двухатомного спирта — этиленгликоля (этандиола) боргидридами или алюмогидридами щелочных металлов (натрия, лития, калия).
При мягком окислении (фелингова жидкость, аммиачный раствор оксида серебра(I) и т.п.) гликольальдегида образуется гликолевая кислота (гидроксиэтановая кислота). При более жестком окислении (перманганат калия, оксид хрома(VI) и т.п.) окисляется не только альдегидная группа, но и гидроксильная, при этом образуется щавелевая кислота (этандиовая кислота), которая впоследствии окисляется до углекислого газа.
Биологическая роль, получение и применение[править | править код]
Гликольальдегид является предшественником многих биологически активных соединений, например аминокислоты глицина. Также гликольальдегид в качестве промежуточного вещества участвует в некоторых биохимических процессах.[4]
Например, гликольальдегид образуется при катаболизме пуринов. При этом ксантин сначала преобразуется в соль мочевой кислоты, которая декарбоксилируется до аллантоина и аллантоиновой кислоты, которые гидролизируют до мочевины и гликольальдегида.
Образующийся гликольальдегид взаимодействует с фосфорной кислотой и конденсируется с образованием эритрозо-4-фосфата, который вступает в пентозофосфатный цикл.
Гликольальдегид также образуется под действием кетолазы из фруктозо-1,6-бисфосфата при альтернативном пути гликолиза. При этом образующийся гликольальдегид фосфорилируется при помощи тиаминпирофосфат и вступает в пентозофосфатный цикл.
Согласно астрохимическим данным гликольальдегид содержится в газопылевом облаке вокруг двойной звезды IRAS 16293-2422 вблизи центра нашей Галактики[5].
В лабораторных условиях гликольальдегид может быть получен химически путём при мягком окисления этандиола (например, пероксидом водорода в присутствии катализатора).
- Каррер, П. Курс органической химии. — М.: Химия, 1960. — 1216 с.
- Кочетков, Н.К. Химия углеводов / Н. К. Кочетков, А. Ф. Бочков, Б. А. Дмитриев. – М.: Наука, 1967. – 672 с.
- Березин, Б. Д. Курс современной органической химии: Учебное пособие / Б. Д. Березин. – М: Высшая школа, 1999. – 768 с.
- Чичибабин, А. Е. Основные начала органической химии: Т. 2 / А. Е. Чичибабин. — 6 изд.. — М.:Наука, 1958. — 974 с.
- ↑ Thisbe K. Lindhorst. Essentials of Carbohydrate Chemistry and Biochemistry (англ.). — 1st. — Wiley-VCH (англ.)русск., 2007. — ISBN 3-527-31528-4.
- ↑ 1 2 Чичибабин, А. Е. Основные начала органической химии: Т. 2 / А. Е. Чичибабин. — 6 изд.. — М.:Наука, 1958. — 974 с.
- ↑ Рабинович, В. А. Краткий химический справочник / В. А. Рабинович, З. Я. Хавин. – 2-е изд. испр. и доп. – Л.: Химия, 1978. – 392 с.
- ↑ Племенков, В. В. Введение в химию природных соединений /В. В. Племенков. – Казань, 2001. – 376 с.
- ↑ Hollis, J.M., Lovas, F.J., & Jewell, P.R. Interstellar Glycolaldehyde: The First Sugar (англ.) // The Astrophysical Journal : journal. — IOP Publishing, 2000. — Vol. 540, no. 2. — P. 107—110. — doi:10.1086/312881. — Bibcode: 2000ApJ…540L.107H. Архивировано 3 декабря 2008 года.
| Общие: | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Геометрия | |||||||||||||||
| Моносахариды |
| ||||||||||||||
| Мультисахариды | |||||||||||||||
| Производные углеводов | |||||||||||||||
Глиоксиловая кислота — Википедия
Глиоксиловая (или глиоксалевая кислота, оксоэтановая кислота) — органическое вещество, первый член гомологического ряда α-альдегидокислот. Вместе с уксусной, гликолевой, и щавелевой кислотами относится к группе C2 (двууглеродных) карбоновых кислот. Глиоксиловая кислота является бифункциональным соединением и помимо карбоксильной группы содержит карбонильную группу в α-положении, поэтому классифицируется как оксокислота (не следует путать с окси-, или гидроксикислотами).
В чистом виде выделить глиоксиловую кислоту невозможно, удается получить лишь её моногидрат. Поэтому данной кислоте также приписывают формулу дигидроксиуксусной кислоты CH(OH)2-COOH. Спектроскопия ЯМР показывает, что в водных растворах кислоты устанавливается равновесие между формой диола и полуацеталя [2]:
2CH(HO)2−COOH↽−−⇀O[(HO)CH−COOH]2+h3O{\displaystyle {\ce {2CH(HO)2-COOH <=> O[(HO)CH-COOH]2{+}h3O}}}
При нейтральных pH глиоксиловая кислота существует в водном растворе в диссоциированной форме. Сопряженное основание глиоксиловой кислоты называется глиоксилат анион.
Известно значение константы Генри для глиоксиловой кислоты KH=1.09×104×exp[(40.0×103/R)×(1/T−1/298)]{\displaystyle K_{H}=1.09\times 10^{4}\times \exp[(40.0\times 10^{3}/R)\times (1/T-1/298)]}[3]
Промышленный способ получения глиоксиловой кислоты основан на реакции окисления глиоксаля 65% горячей (40-90°C) азотной кислотой. Основным побочным продуктом в данной реакции является щавелевая кислота, которая отделяется низкотемпературной кристаллизацией. Глиоксаль также может быть окислен до глиоксиловой кислоты на аноде путём электролиза раствора в присутствии хлоридов. Каталитическое окисление этилена или ацетальдегида обладает низкой селективностью, в связи с чем не используется при промышленном получении глиоксиловой кислоты.
Теоретически, возможно получение глиоксиловой кислоты, окислением акрилонитрила перманаганатом калия в кислой среде (KMnO4+h3SO4), но метод не доказан.
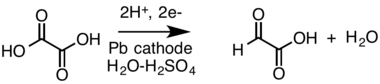
Частичное электровосстановление щавелевой кислоты на катоде, дает достаточно хороший выход реакции (85%), однако связано с техническими трудностями, обусловленными пассивацией свинцового электрода. Данный способ получения глиоксиловой кислоты был предложен в 1904 году швейцарским химиком Юлиусом Тафелем[4][5]:
В качестве эффективного способа получения может быть назван озонолиз малеиновой кислоты[2].
Также глиоксиловую кислоту можно получить гидратацией дихлоруксусной и дибромуксусной кислот [6].
Химические свойства и использование[править | править код]
Как и другие α-альдегидо- и α-кетокислоты глиоксиловая кислота более сильная чем уксусная и пропионовая. Это обусловленно стибилизирующим действием карбонильной группы на анионы α-альдо- и α-кетокислот [7]. Значение константы диссоциации для глиоксиловой кислоты: 4.7 × 10−4 (pKa = 3.33):
- (HO)2CHCOOH ←→{\displaystyle {\overrightarrow {\leftarrow }}} (HO)2CHCO2− + H+
При нагревании и реакции с горячими щелочами происходит дисспропорционирование глиоксиловой кислоты с образование гликолевой и щавелевой кислоты или соответствующих солей:
- 2 OCHCOOH + H2O → HOCH2COOH + HOOC–COOH
- 2 OCHCOOH + 3 KOH → HOCH2COOK + KOOC–COOK + 2 H2O
Глиоксиловая кислота легко окисляется азотной кислотой с образованием щавелевой кислоты.
Глиоксиловая кислота проявлет некоторые типичные свойства альдегидов. В частности глиоксалевая кислота образует гетероциклические соединения в реакциях нуклеофильного присоединения с мочевиной, с 1,2-диаминобензолом.
Для глиоксиловой кислоты характерны разнообразные реакции конденсации с фенолами, которые используются в органическом синтезе.
Использование в органическом синтезе[править | править код]
При реакции конденсации с фенолом образуется 4-гидроксиминдальная кислота. Восстановление 4-гидроксоминдальной кислоты позволяет получить 4-гидроксифенилуксусную кислоту, являющуюся важным предшественником в синтезе многих лекарственных препаратов (например при синтезе атенолола).
При реакции с гваяколом образуется ванилилминдальная кислота, окислительное декарбоксилирование которой позволяет получить ванилин («лигниновый способ») [2][8][9].
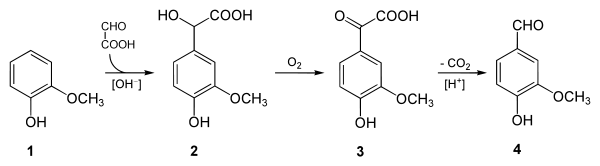
Глиоксиловая кислота является исходным компонентом при синтезе хелатора иона Fe3+ EHPG (N,N-ethylenebis[2-(2-hydroxyphenyl)glycine])[2]. Комплекс EHPG и трехвалентного железа рассматривается как потенциальное контрастное вещество при магнитнорезонансоном исследовании[10][11].
Также глиоксиловая кислота используется для синтеза 4-гидроксофенилглицина, который является интермедиатом при полусинтетическом получении амоксициллина.
Реакция Хопкинса-Кола на триптофан[править | править код]
Глиоксиловая кислота является одним из компонентов реактива Хопкинса-Кола (Hopkins, Cole). Данный реагент применяется в биохимии для детекции остатков триптофана в белках[12][13][14].
Нахождение и роль в природе[править | править код]
Глиоксиловая кислота содержится в незрелых фруктах, по мере созревания её количество уменьшается [6].
Глиоксиловая кислота является компонентом многих метаболических путей живых организмов. Глиоксилат является интермедиатом глиоксилатного цикла, который позволяет многим живым организмам, таким как бактерии[15], грибы и растения[16] конвертировать жирные кислоты в углеводы. Кроме того в клетках растений глиоксилат образуется в пероксисомах результате окисления гликолата в ходе фотодыхания (гликолатный цикл).
ЛД50 для крыс при оральном введении составляет 2500 мг/кг. Мутагенный эффект не обнаружен[2].
- ↑ Merck Index, 11th Edition, 4394
- ↑ 1 2 3 4 5 Georges Mattioda and Yani Christidis “Glyoxylic Acid” Ullmann’s Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a12_495
- ↑ Ip, H. S. Simon; Huang, X. H. Hilda; Yu, Jian Zhen. Effective Henry’s law constants of glyoxal, glyoxylic acid, and glycolic acid (англ.) // Geophysical Research Letters (англ.)русск. : journal. — Vol. 36, no. 1. — doi:10.1029/2008GL036212.
- ↑ Tafel, Julius; and Friedrichs, Gustav. Elektrolytische Reduction von Carbonsäuren und Carbonsäureestern in schwefelsaurer Lösung (нем.) // Berichte der deutschen chemischen Gesellschaft (англ.)русск. : magazin. — 1904. — Bd. 37, Nr. 3. — S. 3187—3191. — doi:10.1002/cber.190403703116.
- ↑ Cohen, Julius. Practical Organic Chemistry 2nd Ed (неопр.). — London: Macmillan and Co. Limited, 1920. — С. 102—104.
- ↑ 1 2 Грандберг И.И. Органическая химия: Учб. для студ. вузов — М.: Дрофа, 2004. — 672 с. ISBN 5-7107-8771-X
- ↑ Травень В.Ф. Органическая химия: учебник для вузов: в 2 т. — М.: ИКЦ «Академкнига», 2008. — ISBN 978-5-94628-318-2
- ↑ Fatiadi, Alexander; and Schaffer, Robert. [http://nvlpubs.nist.gov/nistpubs/jres/78A/jresv78An3p411_A1b.pdf An Improved Procedure for Synthesis of DL-4-Hydroxy-3-methoxymandelic Acid (DL-«Vanillyl»-mandelic Acid, VMA)] (англ.) // Journal of Research of the National Bureau of Standards — A. Physics and Chemistry : journal. — 1974. — Vol. 78A, no. 3. — P. 411—412. — doi:10.6028/jres.078A.024.
- ↑ Kamlet, Jonas; and Mathieson, Olin. Manufacture of vanillin and its homologues U.S. Patent 2,640,083 (англ.). — U.S. Patent Office, 1953.
- ↑ Kuźnik N., Jewuła P., Oczek L., Kozłowicz S., Grucela A., Domagała W. EHPG iron(III) complexes as potential contrast contrast agents for MRI (неопр.) // Acta Chim Slov.. — 2014. — Т. 61. — С. 87—93. — PMID 24664331.
- ↑ Liu G. C., Wang Y. M., Jaw T. S., Chen H. M., Sheu RS. Fe(III)-EHPG and Fe(III)-5-Br-EHPG as contrast agents in MRI: an animal study (англ.) // J Formos Med Assoc : journal. — 1993. — Vol. 92. — P. 359—366. — PMID 8104585.
- ↑ R.A. Joshi. Question Bank of Biochemistry (неопр.). — New Age International, 2006. — С. 64. — ISBN 978-81-224-1736-4.
- ↑ Debajyoti Das. Biochemistry (неопр.). — Academic Publishers, 1980. — С. 56. — ISBN 978-93-80599-17-5.
- ↑ P. M. Swamy. Laboratory Manual on Biotechnology (неопр.). — Rastogi Publications, 2008. — С. 90. — ISBN 978-81-7133-918-1.
- ↑ Holms W. H. Control of flux through the citric acid cycle and the glyoxylate bypass in Escherichia coli (англ.) // Biochem Soc Symp. : journal. — 1987. — Vol. 54. — P. 17—31. — PMID 3332993.
- ↑ Escher C. L., Widmer F. Lipid mobilization and gluconeogenesis in plants: do glyoxylate cycle enzyme activities constitute a real cycle? A hypothesis (англ.) // Biol Chem. (англ.)русск. : journal. — 1997. — Vol. 378, no. 8. — P. 803—813. — PMID 9377475.
| Тривиальное название | Название по ИЮПАК | Структурная или рациональная формула | Название солей и сложных эфиров | Регистрационный номер по СAS |
|---|---|---|---|---|
| Абиетиновая кислота | (4aR)-1,2,3,4,4ar,4bt,5,6,10,10at-декагидро-7-изопропил-1c,4-диметил-фенантренкарбоновая кислота | 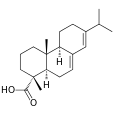 | ||
| Абрин | (2S)-3-(1H-индол-3-ил)-2-(метиламино)пропановая кислота | |||
| Абсцизовая кислота | (2Z,4E)-5-[(1S)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил]-3-метилпента-2,4-диеновая кислота | 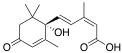 | ||
| Агарициновая кислота | 2-гидрокси-1,2,3-нонадекантрикарбоновая кислота | CH3(CH2)15CH(COOH)C(OH)(COOH)CH2COOH | ||
| Адипиновая кислота | гександиовая кислота | HOOC(СH2)4COOH | адипинаты | |
| Азароновая кислота | 2,4,5-триметоксибензойная кислота | |||
| Азелаиновая кислота | нонандиовая кислота | HOOC(СH2)7COOH | азелаинаты | |
| Аконитовая кислота | пропен-1,2,3-трикарбоновая кислота | HOOCCH2C(COOH)=CHCOOH | ||
| Аконовая кислота | 2,5-дигидро-5-оксо-3-фуранкарбоновая кислота | ChemSpider: 14482627 | ||
| Акриловая кислота | пропеновая кислота | H2C=CHCOOH | акрилаты | |
| α-Аланин | 2-аминопропановая кислота | CH3CH(NH2)COOH | ||
| Алейритовая кислота | 9,10,16-тригидроксигексадекановая кислота | HO(CH2)6CH(OH)CH(OH)(CH | ||
| Аллантоиновая кислота | диуреидоуксусная кислота | 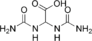 | ||
| Аллиинruen | 2-амино-3-проп-2-енилсульфонилпропановая кислота | 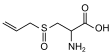 | ||
| Аллокоричная кислота | цис-3-фенилпропеновая кислота | С6Н5СН=СНСООН | ||
| Аллоксановая кислота | 4-гидрокси-2,5-диоксо-4-имидазолидинкарбоновая кислота | |||
| Аллосантеновая кислота | 1-цис-2-диметилциклопентан-1-цис-3-дикарбоновая кислота | C9H14O4 | ||
| D-Аллослизевая кислота | (2R,3R,4S,5S)-2,3,4,5-тетрагидроксибутандиовая кислота | HOOCCH(OH)CH(OH)CH(OH)CH(OH)COOH | ||
| Аллофановая кислота | карбоксиломочевина | NH2СОNHCOOH[1] | аллофанаты | |
| Ангеликовая кислотаru | транс-2-метил-2-бутеновая кислота | СН3СН=С(СН3)СООН | ||
| Ангидроэкгонин | (см. экгонидин) | |||
| п-Анисовая кислота | 4-метоксибензойная кислота | |||
| Антраниловая кислота | 2-аминобензойная кислота | |||
| 1-Антройная кислота | 1-антраценкарбоновая кислота | 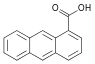 | ||
| 2-Антройная кислота | 2-антраценкарбоновая кислота | 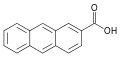 | ||
| 9-Антройная кислота | 9-антраценкарбоновая кислота | 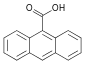 | ||
| Апокамфорная кислота | 2,2-диметил-1,3-циклопентандикарбоновая кислота | |||
| Апофенхокамфорная кислота | цис-4,4-диметилциклопентан-1,3-дикарбоновая кислота | |||
| Арахидоновая кислота | цис-5,8,11,14-эйкозатетраеновая кислота | CH3(CH2)3(CH2CH=CH)4(CH2)3COOH | ||
| Арахиновая кислота | эйкозановая кислота | C19H39COOH | арахаты | |
| Аргинин | 2-амино-5-гуанидинопентановая кислота | 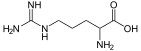 | ||
| Арекаидин | 1,2,5,6-тетрагидро-1-метилпиридин-3-карбоновая кислота | 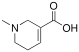 | ||
| Аристолоховая кислотаruen | 3,4-метилендиокси-8-метокси-10-нитрофенантрен-1-карбоновая кислота | 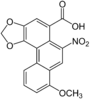 | ||
| Аспарагин | 4-амид-2-аминобутандиовая кислота | HOOCCH(NH2)CH2CONH2 | ||
| Аспарагиновая кислота | 2-аминобутандиовая кислота | HOOCCH2CH(NH2)COOH | аспарагинаты | |
| Атролактиновая кислота | 2-гидрокси-2-фенилпропановая кислота | CH3C(C6H5)(OH)COOH | ||
| Атроповая кислота | 2-фенилпропеновая кислота | CH2=C(C6H5)COOH | ||
| Ацетилендикарбоновая кислота | бутиндиовая кислота | HOOCC≡CCOOH | ||
| Ацетоуксусная кислота | 3-оксобутановая кислота | CH3COCH2COOH | ||
| Ацетуровая кислота | N-ацетиламиноуксусная кислота | CH3CONHCH2COOH | ||
| Баикиаин | 1,2,3,6-тетрагидропиридин-2-карбоновая кислота | |||
| Бегеновая кислота | докозановая кислота | C21H43COOH | бегенаты | |
| Бегенолевая кислота | 13-доказиновая кислота | CH3(CH2)7C≡C(CH2)11COOH | ||
| Бензиловая кислотаruen | гидроксидифенилуксусная кислота | (C6H5)2C(OH)COOH | ||
| Бензойная кислота | бензойная кислота | 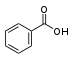 | бензоаты | |
| Бербероновая кислота | пиридин-2,4,5-трикарбоновая кислота | ChemSpider: 9075159 | ||
| Бетулиновая кислота | 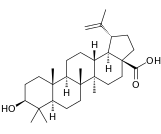 | |||
| Билиановая кислота | 7,12-диоксо-3,4-секо-5β-холан-3,4,24-триовая кислота | |||
| Биотин | 5-(7-оксо-3-тиа-6,8-диазабицикло[3.3.0]октил-2)пентановая кислота | 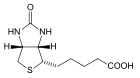 | ||
| Брассидиновая кислота | транс-13-докозеновая кислота | CH3(СH2)7CH=CH(СH2)11COOH | ||
| Брассиловая кислота | тридекандиовая кислота | HOOC(СH2)11COOH | ||
| Валериановая кислота | пентановая кислота | C4H9COOH | валераты | |
| Валин | 2-амино-3-метилбутановая кислота | (CH3)2CHCH(NH2)COOH | ||
| Вальпроевая кислота | 2-пропилпентановая кислота | CH3CH2CH2CH(COOH)CH2CH2CH3 | вальпроаты | |
| Ванилилминдальная кислота | 2-гидрокси-2-(4-гидрокси-3-метоксифенил)уксусная кислота | 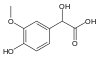 | ||
| Ванилиновая кислота | 4-гидрокси-3-метоксибензойная кислота | |||
| Вацценовая кислотаruen | 11-октадеценовая кислота | CH3(CH2)5CH=CH(CH2)9COOH | ||
| Вератровая кислота | 3,4-диметоксибензойная кислота | |||
| Верноловая кислотаruen | цис-12,13-эпокси-9-октадеценовая кислота | |||
| Винная кислота | 2,3-дигидроксибутандиовая кислота | НООССН(ОН)СН(ОН)СООН | тартраты | |
| Виноградная кислота[2] | DL-винная кислота | |||
| Гадолеиновая кислота | цис-9-эйкозеновая кислота | CH3(CH2)9CH=CH(CH2)7COOH | ||
| Галактаровая кислота | (см. слизевая кислота) | |||
| D-Галактуроновая кислота | (2S,3R,4S,5R)-2,3,4,5-тетрагидро-6-оксогексановая кислота |  | ||
| Галловая кислота | 3,4,5-тригидроксибензойная кислота | 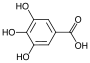 | галлаты | |
| Геддовая кислота | тетратриаконтановая кислота | CH3(CH2)32COOH | ||
| Гематиновая кислота | 2,5-дигидро-2,5-диоксо-4-метил-1H-пиррол-3-пропановая кислота | |||
| Гемеллитиловая кислота | 2,3-диметилбензойная кислота | |||
| Гемимеллитовая кислота | 1,2,3-бензолтрикарбоновая кислота | |||
| Гемипиновая кислота | 3,4-диметокси-1,2-бензолдикарбоновая кислота | |||
| Гентизиновая кислота | 2,5-дигидроксибензойная кислота | 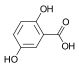 | ||
| Героновая кислота | 2,2-диметил-6-оксогептановая кислота | CH3C(=O)CH2CH2CH2CH(CH3)2COOH | ||
| Гесперетиновая кислота | (2E)-3-(3-гидрокси-4-метоксифенил)-2-пропеновая кислота | |||
| Гетероауксин | 1H-индол-3-уксусная кислота | 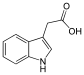 | ||
| Гидантоиновая кислота | уреидоуксусная кислота | H2NCONHCH2COOH | ||
| Гиднокарповая кислота | 11-(2-циклопентенил)ундекановая кислота | |||
| Гидракриловая кислотаruen | 3-гидроксипропановая кислота | HOCH2CH2COOH | ||
| Гидратроповая кислота | 2-фенилпропановая кислота | C6H5CH(CH3)COOH | ||
| Гидрокоричная кислотаruen | 3-фенилпропановая кислота | C6H5(CH2)2COOH | ||
| Гиппуровая кислота | N-бензоиламиноуксусная кислота | C6H5CONHCH2COOH | ||
| Гистидин | 2-амино-3-(4-имидазолил)пропановая кислота | 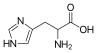 | ||
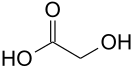
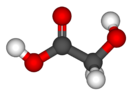
| Гликолевая кислота | гидроксиуксусная кислота | HOCH2COOH | ||
| Гликохолевая кислота | гликохолаты | |||
| Глиоксиловая кислота | оксоуксусная кислота | HCOCOOH | ||
| Глицериновая кислота | 2,3-дигидроксипропановая кислота | HOCH2CH(OH)COOH | ||
| Глицин | аминоуксусная кислота | H2NCH2COOH | ||
| Глицирризиновая кислота | 20β-карбокси-11-оксо-30-норолеан-12-ен-3β-ил-2-О-β-D-глюкопирануронозил-альфа-D-глюкопиранозидуроновая кислота | 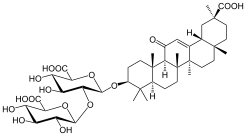 | ||
| Глутаконовая кислотаruen | 2-пентендиовая кислота | HOOCCH=CHCH2COOH | ||
| Глутамин | 5-амид-2-аминопентадиовая кислота | HOOCCH(NH2)CH2CH2CONH2 | ||
| Глутаминовая кислота | 2-аминопентандиовая кислота | HOOC(CH2)2CH(NH2)COOH | глутаматы | |
| Глутаровая кислота | пентандиовая кислота | HOOC(СH2)3COOH | глутараты | |
| Глюконовая кислота | 2,3,4,5,5-пентагидрогексановая кислота | глюконаты | ||
| Глюкуроновая кислота | тетрагидро-3,4,5,6-тетрагидроксипиран-2-карбоновая кислота | 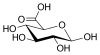 | глюкуронаты | |
| Гомованилиновая кислота | 4-гидрокси-3-метоксифенилуксусная кислота | 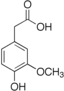 | ||
| Гомовератровая кислота | 3,4-диметоксифенилуксусная кислота | |||
| Гомогентизиновая кислота | 2,5-дигидроксифенилуксусная кислота | 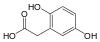 | ||
| Гомокамфорная кислота | 3-(карбоксиметил)-1,2,2-триметилциклопентанкарбоновая кислота |
Глиоксаль — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 14 июля 2019; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 14 июля 2019; проверки требуют 3 правки.Глиоксаль — органическое соединение, диальдегид щавелевой кислоты, жёлтая жидкость с запахом формалина. Является простейшим диальдегидом.
В лаборатории глиоксаль получают окислением ацетальдегида селенистой кислотой.[1]
В промышленности глиоксаль получают двумя путями. Либо окислением в газовой фазе этиленгликоля в присутствии серебряного или медного катализатора, либо окислением в жидкой фазе ацетальдегида азотной кислотой. Более распространенным является окисление в газовой фазе.
Объем ежегодного производства составляет ~220,000 тонн.
Первое коммерческое производство началось в Lamotte, Франция, в 1960 и сейчас принадлежит Clariant. Единый большой производитель — BASF в Людвигсхафен-на-Рейне, Германия, с производительностью 60,000 тонн/год. Только два производства глиоксаля есть в Америке (Geismer, LA and Charlotte, NC). Значительное производство недавно началось в Китае. Коммерческий глиоксаль поставляется в виде 40 % раствора.
В России глиоксаль производит единственная компания Новохим (Novochem), с производительностью 1500 тонн/год в Томске и с сентября 2012 г. в Бийске[2].
Получение безводного глиоксаля включает нагревание твёрдых глиоксаль гидратов с фосфора пентаоксидом и конденсация паров в охлаждаемой ловушке.
Карбонильные группы глиоксаля обладают ярко выраженными электрофильными свойствами. С водой глиоксаль образует дигидрат, становясь из желтого бесцветным.
Под действием щелочи глиоксаль претерпевает внутримолекулярную реакцию Канниццаро, превращаясь в соответствующую соль гликолевой кислоты.
В присутствии поташа на воздухе окисляется до родизоновой кислоты
Кислым раствором перманганата калия или перекисью водорода окисляется до муравьиной кислоты. Щелочным раствором перманганата калия до щавелевой кислоты. Гидрирование на палладии (Pd/C) даёт этиленгликоль. Со спиртами в присутствии кислоты получается моно- или диацетали. С мочевиной образует 4,5-дигидроксиимидазол (1) и глиоксальуреид(2).
Он используется для придания нерастворимости и как агент кросс-сочетания в химии полимеров:
- белков (процесс дубления кожи)
- коллаген
- производные целлюлозы (текстиль)
- гидроколлоиды
- крахмал (мелование бумаги)
Глиоксаль — текстильно-вспомогательное вещество, придающее несминаемость хлопчатобумажным и вискозным материалам; гидрофобизирующий компонент составов для пропитки бумаги и кожи. Глиоксаль и глиоксальсульфат используются для получения кубовых красителей.[3]
Глиоксаль ценный строительный блок в органическом синтезе, особенно в синтезе гетероциклов таких как имидазол. Обычная форма этого реагента используемого в лабораториях — бис-полуацеталь с этиленгликолем 1,4-диоксан-2,3-диол. Он доступен коммерчески.
Глиоксаль типично поставляется в виде 40% водного раствора. Как и другие младшие альдегиды, глиоксаль образует гидраты. Более того, гидраты конденсируются образуя серии олигомеров, структуры которых остаются неизвестными. Для большинства применений точное знание об этих олигомерах не имеет значения. По крайней два типа гидратов доступны коммерчески и являются твёрдыми веществами.
- глиоксаль димер, дигидрат: [(CHO)2]2(H2O)2, 1,4-диоксан-транс-2,3-diol (CAS# 4845-50-5, т.пл. 91-95 C)
- глиоксаль тример, дигидрат: [(CHO)2]3(H2O)2 (CAS# 4405-13-4). Не гигроскопичен.
Установлено что, при концентрации меньшей 1М, глиоксаль существует в основном как мономер или его гидраты, OCHCHO, OCHCH(OH)2 или(HO)2CHCH(OH)2.
При концентрации >1М, димер доминирует. Эти димеры скорее всего диоксоланы с формулой [(HO)CH]2O2CHCHO. Димер и тример может выпасть в осадок из-за низкой растворимости ниже 15 °C.
Беречь от прямых солнечных лучей. Раздражает кожу. Операции проводить в вытяжном шкафу.
Гликолевая кислота — Вики
| Гликолевая кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | Гликолевая кислота | ||
| Хим. формула | HOOCCH2OH | ||
| Физические свойства | |||
| Состояние | Бесцветные кристаллы | ||
| Молярная масса | 76,05 г/моль | ||
| Плотность | 1,27 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | +79 °С | ||
| Химические свойства | |||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 3,83 при +25 °С | ||
| Классификация | |||
| Рег. номер CAS | 79-14-1 | ||
| PubChem | 757 | ||
| Рег. номер EINECS | 201-180-5 | ||
| SMILES | O=C(O)CO | ||
| InChI | 1S/C2h5O3/c3-1-2(4)5/h4H,1h3,(H,4,5)AEMRFAOFKBGASW-UHFFFAOYSA-N | ||
| RTECS | MC5250000 | ||
| ChEBI | 17497 | ||
| ChemSpider | 737 | ||
| Безопасность | |||
| NFPA 704 |  0
3 0
3 | ||


 (
(