Колагенові волокна: Коллагеновые волокна кожи – 21. Коллагеновые волокна – строение и функции.
Коллагеновые волокна кожи
Коллагеновые волокна играют важную роль в человеческом организме. Они отвечают не только за упругость кожи, но и поддерживают структуру внутренних органов. Сегодня коллаген также активно используют в косметологии. Благодаря этому кожа выглядит более молодо и привлекательно. В нашей статье вы можете ознакомиться с более подробной информацией о коллагеновых волокнах и их функциях.
Общая информация о коллагеновых волокнах
Коллагеновые волокна — это фибриллярный белок. Он является одной из составляющих соединительной ткани тела. Волокна обеспечивают ей эластичность и прочность. Они присутствуют у всех многоклеточных животных. Коллагеновые волокна отсутствуют у растений, животных, грибов и микроорганизмов.
Волокна коллагена — это самый распространенный белок у млекопитающих. Его содержание в организме колеблется от 25 %. Продуктом денатурации коллагена является желатин.
Функция коллагеновых волокон играет важную роль в жизни женщин. Не секрет, что они больше, чем представители мужского пола, переживают за свой внешний вид. Благодаря высокому содержанию волокон можно замедлить процесс старения и избавиться от некоторых морщин. Они также используются во многих сферах нашей жизнедеятельности, а именно в пищевой промышленности, косметологии, науке и медицине.
Синтез волокон
Синтез коллагеновых волокон — сложный процесс, который протекает при наличии достаточного количества витаминов и микроэлементов. Он проходит в фибробласте. Один из самых важных моментов в процессе — реакция гидроксилирования, которая позволяет продолжить дальнейший процесс формирования коллагена. Катализатором являются специфические ферменты.
Синтез коллагеновых волокон может нарушить дефицит аскорбиновой кислоты. В таком случае будет формироваться так называемый аномальный коллаген. По своей консистенции он более рыхлый. Такой синтез может быть причиной развития цинги.
Коллагеновые, эластиновые волокна — это основа кожного покрова. Первый прекращает вырабатывать ферменты в возрасте 20-25 лет, а второй в 13-14 лет. После этого кожа не восстанавливается, начинается процесс старения. Однако сегодня существует огромное количество косметических средств, в состав которых входит коллаген. Благодаря им можно частично восстановить кожный покров и избавиться от неглубоких морщин.
Образование волокон
Образование коллагеновых волокон регулируется проколлаген-пептидазами. Такие молекулы не способны на спонтанное формирование. Для образования волокон необходимо предварительное отщепление N- и С-концевых пептидов. Из этого следует, что формирование волокон коллагена совпадает с образованием нитей фибрина. В двух этих процессах главным условием является специфическое протеолитическое расщепление.

Коллагеновое волокно формируется во внеклеточной жидкости недалеко от поверхности фибробласта, но ни в коем случае не внутри него. Это связано с тем, что проколлаген-пептидазы находятся за пределами данной клетки. Конечные пептиды препятствуют несвоевременному формированию белка.
Состав волокон
Коллагеновые волокна состоят из фибрилл и включают в себя специфический белок — коллаген. Они необычайно прочны и имеют способность к набуханию. В зависимости от расположения аминокислот в полипептидных цепочках, а также от качества углеводного компонента различают более 10 типов белка коллагена. Данные разновидности входят не только в состав коллагеновых волокон, но и в базальные мембраны эпителиальных и хрящевых тканей, а также других структур. При развитии определенных патологических процессов может произойти распад коллагена. В связи с этим он попадает в кровь.
В состав коллагеновых волокон входит также:
- аргинин;
- лейцин;
- валин;
- серин;
- тирозин и другие полезные вещества.
Старение волокон
Со временем коллагеновые волокна стареют. Это неизбежный процесс, который невозможно остановить. Он затрагивает все аспекты жизни. Постепенно снижается трудоспособность, ухудшается самочувствие и происходит существенное изменение внешнего вида.
Старение коллагеновых волокон вызывает изменение кожных покровов в возрасте 33-35 лет. В связи с этим появляются морщины. Современные процедуры омоложения и пластические операции позволяют существенно замедлить данный процесс. Однако они достаточно дорогостоящие. Продолжительность эффекта от таких процедур индивидуальна. К сожалению, некоторым они не подходят. Согласно результатам исследования, которые проводили специалисты, некоторые люди имеют переизбыток коллагена третьего типа. Из-за этого они имеют предрасположенность к раннему старению. Проведенные процедуры по омоложению будут иметь непродолжительный эффект.
Не секрет, что с возрастом человек с трудом достает кончиками пальцев до пола, не сгибая ног в коленях. Это связано с тем, что со временем уменьшается амплитуда сгибания позвоночника и конечностей. Ограничителем степени растяжения является коллаген. Он защищает ткань от перерастяжений, а также повреждений сосудов и нервов. Специалисты рекомендуют регулярно заниматься спортом, несмотря на возраст. Они утверждают, что это позволит улучшить коллагеновые волокна и чувствовать себя как можно лучше.

Восстановление коллагеновых волокон
Специалисты со всего мира на протяжении многих лет желают создать идеальное вещество, которое позволит восстановить коллагеновые волокна. Подобной функцией обладает аскорбиновая кислота, пептиды и растительные экстракты. Именно их активно используют при создании специальных кремов и масок. Однако такой состав не дает 100%-го результата. Ученые научились дробить молекулы перечисленных компонентов и заключать их в особые составы. Благодаря этому вещество проходит сквозь эпидермис.
Сегодня любой желающий может приобрести косметическое средство, в состав которого входят коллагеновые волокна. Однако специалисты утверждают, что в таком случае молекулы велики и не способны проникнуть в кожный покров для того, чтобы восстановить количество коллагена в организме. К положительным качествам такого средства можно отнести только то, что оно увлажняет верхний слой покрова.
Для предотвращения процесса старения и восстановления уровня коллагена специалисты рекомендуют инъекции. Таким образом белок доставляется глубоко в кожу и положительно воздействует на ее состояние.
Для того чтобы замедлить процесс старения, который возникает из-за прекращения выработки ферментов коллагеновыми волокнами, необходимо в обязательном порядке вести здоровый образ жизни. Известно пять врагов коллагеновых волокон:
- курение;
- алкоголь;
- стресс;
- недостаточное увлажнение кожного покрова;
- излишний ультрафиолет.
Правильное питание для выработки коллагена
Питание играет важную роль в выработке коллагена. Важно отдавать предпочтение только качественным, полезным и свежим продуктам. Это связано с тем, что коллагеновые волокна формируются из целого ряда аминокислот, которые поступают в организм только с белками. Их нехватка может сказываться на состоянии кожи, ногтей и волос.
Употребление пищи, которая богата белками, способствует построению полноценной молекулы коллагена. Этим можно объяснить изменение состояния кожи у тех девушек, которые нередко прибегают к самым разнообразным диетам.
Аминокислоты, которые попадают в тело вместе с белком, позволяют организму образовывать собственный коллаген. Однако при недостатке хотя бы одной аминокислоты процесс формирования волокон приостанавливается. Постепенно начинают выпадать волосы, кожа тускнеет, а ногти становятся ломкими.
Каким продуктам стоит отдавать предпочтение для выработки коллагена?
Далеко не все продукты могут помочь восстановить коллагеновые волокна. Наиболее ценным продуктом считается рыба и морепродукты. Особо полезен лосось. Он содержит в своем составе жирные кислоты омега-3, а также богат природным коллагеном. Любой косметолог знает, что морская рыба — это источник здоровья, красоты и молодости. Она в обязательном порядке должна входить в регулярный рацион. Такими же свойствами обладают креветки, крабы, устрицы, мидии и морская капуста. Благодаря данным продуктам можно не только восстановить коллагеновые волокна, но и избавиться от йододефицита.
Еще одним ценным продуктом является мясо индейки. Благодаря ему стабилизируется выработка коллагеновых волокон и предотвращается их преждевременное разрушение. Мало кому известно, но свинина и говядина замедляют формирование коллагена. Именно поэтому рекомендовано отдавать предпочтение именно индейке.
Не секрет, что овощи необычайно полезны для организма. Они являются источником разнообразных витаминов и минералов. Для восстановления коллагеновых волокон важно отдавать предпочтение овощам зеленого цвета. Помимо этого, они позволят нормализовать обменные процессы. Также состояние кожных покровов улучшается при употреблении яблок, моркови и помидоров.
Особое внимание нужно уделить продуктам, которые содержат в себе витамин С. Он является главным стимулятором, от которого зависит эластичность кожи. Витамин С содержится в апельсинах, мандаринах, абрикосах, лимонах и персиках.
Инъекции коллагена
С каждым годом инъекции с коллагеном становятся все более популярными. Стоимость такой процедуры зависит от типа используемого коллагена. Существует три разновидности вещества:
- Животный. Его получают из шкур крупного рогатого скота. Считается, что это самый опасный и неэффективный вид коллагена. Он может вызвать серьезную аллергическую реакцию.
- Растительный. Добывается биотехническим путем из протеинов пшеницы. Такой коллаген не вызывает аллергических реакций. Он используется в косметике класса люкс и отличается высокой стоимостью.
- Морской. Молекулы такого коллагена схожи с теми, которые вырабатываются человеческим организмом. Он доступен по цене, но в некоторых случаях может вызывать аллергическую реакцию.
Волокна коллагена и медицина
Коллагеновые волокна кожи играют важную роль в жизни человечества. Ученые доказали, что нарушение синтеза коллагена в организме лежит в основе многих наследственных заболеваний. К главным проявлениям таких болезней можно отнести:
- повреждение связочного аппарата;
- повреждение хрящей;
- наличие пороков сердечных клапанов.
Болезни, вызванные дефектами при биосинтезе коллагена, возникают из-за множества причин. Они могут быть связаны с мутациями в генах или ошибками модификации коллагена. Еще одна причина — недостаток ферментов. Для борьбы с такими заболеваниями необходимо нормализовать их количество.

Подводим итоги
Почти каждый мечтает замедлить процесс старения. Однако не всем известно, с чем он связан и как с ним бороться. Сегодня существует огромное количество косметических средств с коллагеном. При их приобретении важно обращать внимание на состав. Коллагеновые волокна, которые входят в то или иное средство, не всегда могут гарантировать 100%-й результат. Для восстановления коллагена в организме рекомендуем регулярно заниматься спортом и употреблять только качественную пищу. Благодаря этому коллагеновые волокна будут функционировать с максимальной пользой для организма, а ваша кожа будет оставаться упругой и привлекательной как можно дольше.
21. Коллагеновые волокна – строение и функции.
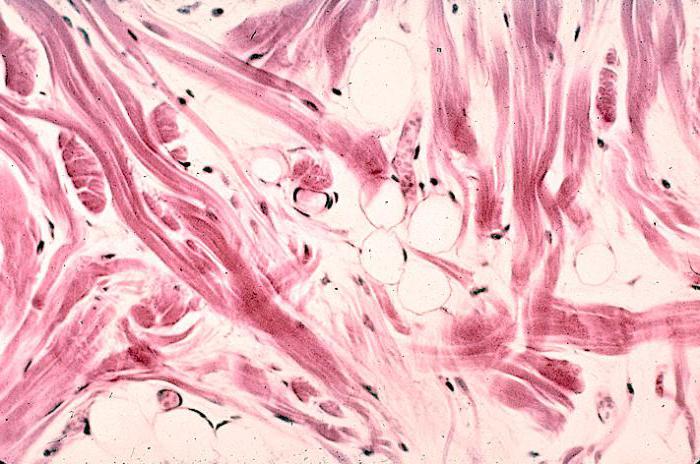
Коллагеновые волокна – основные волокна, обеспечивающие механическую прочность ткани. В рыхлой соединительной ткани они имеют вид лентовидных тяжей, ориентированных в различных направлениях. Волокна не ветвятся, им свойственна малая растяжимость, большая прочность на разрыв, способность объединяться в пучки. При длительной варке коллагеновые волокна образуют клей (колла), откуда и произошло название волокон.
Каждое волокно состоит из фибрилл диаметром до 100 нм, расположенных параллельно друг другу и погруженных в межфибриллярное вещество, содержащее гликопротеиды, гликозаминогликаны и протеогликаны. Под микроскопом по длине фибриллы наблюдают характерную поперечную полосчатость.
Фибрилла состоит из более тонких миофибрилл, образованных молекулами белка тропоколлагена. Микрофибриллы имеют длину 280 – 300 нм и ширину 1,5 нм и являются своеобразными мономерами. Образование фибриллы – результат характерной группировки мономеров в продольном и поперечном направлении. Каждая молекула тропоколлагена представляет собой спираль из трех полипептидных цепей, удерживаемых друг около друга водородными связями. Уникальная структура тропоколлагена обусловлена особенно высоким содержанием в нем глицина (до 38%), а также оксилизина и оксипролина. В зависимости от аминокислотного состава и формы объединения цепей в тройную спираль различают 4 основных типа коллагена, имеющих различную локализацию в организме. Коллаген 1 типа является наиболее распространенным и содержится в соединительной ткани кожи, сухожилий и костях. Коллаген 2 типа имеется преимущественно в гиалиновом и волокнистом хрящах. Коллаген 3 типа преобладает в коже зародышей, стенке кровеносных сосудов, связках. Коллаген 4 типа в базальных мембранах, в полипептидных цепях этого коллагена содержится особенно большое кол – во оксилизина.
Коллагеновые волокна неодинаковы по степени своей зрелости. В составе новообразованных (при воспалительной реакции) волокон имеется значительное количество межфибриллярного цементирующего полисахаридного вещества, которое способно восстанавливать серебро при обработке срезов солями серебра. Поэтому молодые коллагеновые волокна часто называют аргирофильными. В зрелых коллагеновых волокнах количество этого вещества уменьшается, и они утрачивают аргирофилию.
22. Виды хрящевой ткани и где встречаются в организме животного.
2) Эластический хрящ образует скелет наружного уха, слухового прохода, евстахиевых труб, клиновидных и рожковых хрящей гортани. В отличие от гиалинового хряща в состав его межклеточного вещества, кроме аморфного вещества и коллагеновых фибрилл, входит плотная сеть эластических волокон, которая на периферии переходит в ткань надхрящницы. Клетки его идентичны клеткам гиалинового хряща. Они также образуют группы и лишь под надхрящницей лежат одиночно.
3) Волокнистый хрящ локализуется в составе межпозвоночных дисков, круглой связки бедра, в симфизах лобковых костей, в области прикрепления сухожилия к костям. Межклеточное вещество волокнистого хряща содержит грубые пучки параллельно ориентированных коллагеновых волокон. Клетки хряща образуют изогенные группы, вытянутые в обособленные цепочки между пучками коллагеновых волокон. Этот вид хряща в основном представляет собой переходную форму между гиалиновым хрящом и плотной соединительной тканью. Регенерация хряща обеспечивается надхрящницей, клетки которой сохраняют камбиальность.
КОЛЛАГЕНОВЫЕ ВОЛОКНА — это… Что такое КОЛЛАГЕНОВЫЕ ВОЛОКНА?
- КОЛЛАГЕНОВЫЕ ВОЛОКНА
- КОЛЛАГЕНОВЫЕ ВОЛОКНА
(fibrae collageni), разновидность волокон соединит, ткани животного организма. Состоят гл. обр. из белка коллагена, синтезируемого фибробластами, хондробластами и остеобластами. К. в. образованы пучками фибрилл (диам. 20—100 нм), каждая фибрилла состоит из протофибрилл. Последние представляют собой агрегаты молекул (диам. 1—1,5 нм, дл. 270 нм), наз. тропоколлагеном, состоящие из 3 закрученных в спирали полипептидных цепочек проколлагена. К. в. обладают периодичным (через 64 нм) чередованием тёмных и светлых участков (полос). Формируются во внеклеточном пространстве полимеризацией тропоколлагена. К. в. прочны на разрыв и мало эластичны, выполняют механич. (опорную) функцию. В хряще К. в. наз. хондриновыми, в кости — оссеиновыми.
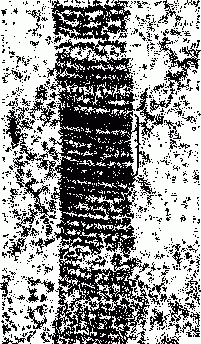
Электронная микрофотография коллагеновой фибриллы. Фигурной скобкой обозначен период повторяемости полос.
.(Источник: «Биологический энциклопедический словарь.» Гл. ред. М. С. Гиляров; Редкол.: А. А. Бабаев, Г. Г. Винберг, Г. А. Заварзин и др. — 2-е изд., исправл. — М.: Сов. Энциклопедия, 1986.)
.
- КОЛЛАГЕН
- КОЛЛАТЕРАЛИ
Смотреть что такое «КОЛЛАГЕНОВЫЕ ВОЛОКНА» в других словарях:
КОЛЛАГЕНОВЫЕ ВОЛОКНА — волокна внеклеточного вещества соединительной ткани животных и человека, состоящие главным образом из белка коллагена, образующегося в фибробластах. Прочны на разрыв и мало эластичны; выполняют механическую функцию … Большой Энциклопедический словарь
коллагеновые волокна — волокна внеклеточного вещества соединительной ткани животных и человека, состоящие главным образом из белка коллагена, образующегося в фибробластах. Прочны на разрыв и мало эластичны; выполняют механическую функцию. * * * КОЛЛАГЕНОВЫЕ ВОЛОКНА… … Энциклопедический словарь
КОЛЛАГЕНОВЫЕ ВОЛОКНА — волокна внеклеточного в ва соединит. ткани животных и человека, состоящие гл. обр. из белка коллагена, образующегося в фибробластах. Прочны на разрыв и мало эластичны; выполняют механич. функцию … Естествознание. Энциклопедический словарь
Коллагеновые волокна — клейдающие волокна, волокна внеклеточного вещества соединительной ткани животных и человека, состоящие главным образом из белка Коллагена. К. в. толщиной 1 12 мкм представлены неветвящимися нитями фибриллами (диаметр 0,3 0,5 мкм).… … Большая советская энциклопедия
волокна предентинные — (f. predentini, LNH; син. Корффа волокна) коллагеновые В., проходящие в наружном слое дентина радиально к длинной оси зуба … Большой медицинский словарь
волокна преколлагеновые — (f. precollagenae, LNH; син. фибриллы преколлагена) В. в составе межклеточного вещества соединительной ткани, образованные белком колластромином, представляющим собой фракцию коллагена; из В. п. формируются коллагеновые В … Большой медицинский словарь
ШАРПЕЕВЫ ВОЛОКНА — прободающие волокна (fibra perfoanscementi), коллагеновые волокна, прикрепляющие надкостницу к кости. Описаны У. Шарпеем. Направлены из внутр. слоя надкостницы на разную глубину в слой наруж. генеральных пластин диафиза трубчатой кости.… … Биологический энциклопедический словарь
Шарпеевы волокна — прободающие волокна, различные по мощности коллагеновые волокна, обусловливающие прочное прикрепление надкостницы к кости; направлены под разными углами из внутреннего слоя надкостницы на разную глубину в слой наружных генеральных пластин … Большая советская энциклопедия
Эбнера волокна — (V. Ebner, 1842 1925, австрийский гистолог и анатом) коллагеновые волокна в околопульпарном дентине, проходящие в тангенциальном направлении относительно оси зуба … Большой медицинский словарь
Мясо — (Meat) Определения мяса, состав и свойства мяса Определения мяса, состав и свойства мяса, кулинарная обработка мяса Содержание Содержание 1.Состав и свойства Автолиз мяса 2.История употребления мяса Мясоедение в антропогенезе Употребление мяса в… … Энциклопедия инвестора
Коллагеновое волокно
 7. Образование
7. Образованиепоперечных
сшивок
Зрелое коллагеновое волокно
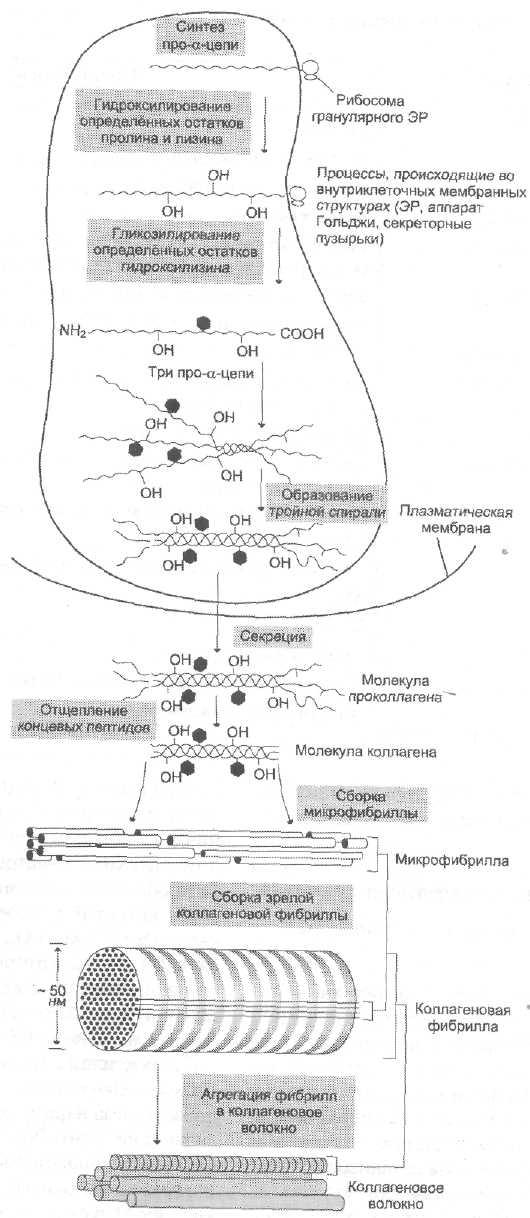
С-концевые пептиды этих цепей предшественников связаны межцепочечными дисульфидными связями, отсутствующими в коллагене. Полипептидные цепи проколлагена с дополнительными пептидами синтезируются в фибробластах и секретируются в межклеточное пространство соединительной ткани. Здесь дополнительные пептиды отщепляются протеолитическими ферментами – проколлагенпептидазами. После их отщепления из образовавшегося тропоколлагена формируется коллагеновое волокно. Причем ряд молекул тропоколлагена смещен по отношению к соседнему ряду молекул примерно на ¼ длины молекулы тропоколлагена (рис.
Проколлаген


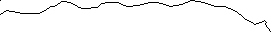
N-концевой
пептид С-концевой
пептид
Проколлагенпептидаза



Тропоколлаген
Рис. Превращение проколлагена в тропоколлаген.
Перекрывание 64-67 нм
























40 нм 400 нм
Рис. Расположение молекулы тропоколлагена в четыре ряда.
Коллагеновым волокнам свойственно два типа поперечных связей: внутримолекулярные – в пределах одной тропоколлагеновой единицы между NН и СО и межмолекулярные – между отдельными тропоколлагеновыми единицами. В образовании внутримолекулярных поперечных связей в коллагене участвуют боковые цепи лизина. Внеклеточный медь-содержащий фермент, лизилоксидаза, осуществляет окислительное дезаминирование ε-аминогрупп некоторых лизиловых и гидроксилизиловых радикалов.

Именно они могут образовывать поперечные связи, реагируя с остатками лизина и оксилизина, а также друг с другом, с образованием шиффовых оснований и альдолей — между полипептидами Р1 и Р2.

Эти шиффовы основания подвергаются химической перегруппировке, обеспечивая стабильные ковалентные сшивки. При дефиците лизилоксидазы или нарушении метаболизма меди нарушается образование поперечных связей, что ведет к аномалиям коллагена — причиной наследственных болезней. Наиболее известные среди них: синдром Марфана, синдром Элерса-Данлоса и синдром Менке (синдром курчавых волос). При этом наблюдается дефекты в развитии скелета повышенная растворимость коллагенов, поражения кожи, сосудов.
Поперечные связи придают коллагеновым волокнам высокую степень упругости. В промежутках между коллагеновыми волокнами костей откладываются кристаллы фосфата кальция.
Известны 19 типов коллагена. Фибриллообразующие: I (кости, роговица, сухожилия), II (хрящи, диски, стекловидное тело), III (почки, печень, сосуды), а также V и ХI-типы характеризуются ступенчатым расположением параллельных рядов (сдвиг на ¼ полипептидной цепи) V и ХI типы в разных количествах присутствуют в межклеточном матриксе всех тканей, определяя диаметр коллагеновых фибрилл.
IХ, ХII, ХIV, ХVI типы не образуют фибрилл, но непосредственно связаны с другими типами (например, IХ со II). IХ тип представляет собой прерывистую тройную спираль, которая состоит из трех коллагеновых и четырех неколлагенных доменов.
Коллаген IV-го типа является компонентом базальных мембран, который секретируется эпителиальными, эндотелиальными, мышечными клетками с повторяющимися спирализированными участками гли- х-у, прерывающимися неспиральными сегментами. Такая особенность структуры коллагена IV-го типа является причиной гибкости и способности к образованию сетчатых структур. Кроме того, этому помогают N- и С- концевые пептиды, которые не отщепляются при созревании коллегативных волокон.
Коллаген VI-го типа образует микрофибриллы, которые локализуется между коллагенами I, II и III-го типов в результате складывания его цепей антипараллельно и в таком виде образованные микрофибриллы секретируются из клетки.
Коллаген VII-го типа является основным структурным компонентом «заякоренных фибрилл», которые располагаются в субэпителиальных слоях. Пучки фибрилл, образованных димерами этого коллагена, соединенных «бок о бок» участвуют в присоединении эпидермиса к дерме.
Вышеуказанные типы несколько отличаются и своим аминокислотным составом, тип I отличается от остальных низким содержанием гидроксилизина. Остальные содержат много гидроксилизина, кроме типа III, который характеризуется высоким содержанием гидроксипролина. V-й тип отличается низким содержанием аланина, и т.д. При кипячении в воде волокнистый, нерастворимый и неперевариваемый коллаген превращается в желатин – растворимую смесь полипепидов, который в кулинарии используется для приготовления желе.
Распад коллагена — единственный источник свободного гидроксипролина в организме, поэтому содержание гидроксипролина в крови и моче отражает баланс скорости катаболизма коллагена. У взрослого человека экскретизируется 15-50 мг гидроксипролина в сутки, при поражении соединительной ткани, например при гиперпаратироидизме с мочой выделяется до 1 г в сутки.
Нативный коллаген не гидролизуется обычными пептидгидролазами. Основной фермент-коллагеназа, расщепляющий пептидные связи в определенных участках спирализованных областей коллагена бывает двух типов.
1. Тканевая коллагеназа синтетизируется клетками соединительной ткани и присутствует у человека в различных органах и тканях. Это металлозависимый фермент, содержит Zn2+ в активном центре, и активность его определяется действием активаторов (калликреин, плазмин) и ингибиторов. Коллагеназа высокоспецифична и перерезает тройную спираль на ¼ расстояния от С-конца. Нарушение катаболизма ведет к фиброзу органов и тканей (печени и легких), усиление его распада происходит при аутоимунных заболеваниях (ревматоидном артрите и системной красной волчанке) в результате избыточного синтеза коллагеназа при иммунном ответе.
2. Бактериальная коллагеназа синтезируется возбудителем газовой гангрены, которая расщепляет полипептидную цепь более чем 200 местах. В результате разрыва связей перед остатками глицина, микроорганизмы проникают через соединительно-тканные барьеры и способствуют развитию газовой гангрены. Коллагеназа используется для лечения ожоговой болезни и в офтальмологии.
Синтез коллагена увеличивается в заживающей ране в результате миграции фибробластов в область раны и синтез ими веществ межклеточного матрикса. На месте раны образуется разновидность соединительной ткани -рубец, основным компонентом которого является коллаген. Аналогично, погибающие клетки печени замещаются соединительной тканью при циррозе, в стенках артерий при атеросклерозе, в мышцах при их дистрофии.
Эластин – белок входящий в состав эластических волокон. Он отличается от коллагена по химическому составу и молекулярной структуре.
Общим для коллагена и эластина является большое содержание глицина и пролина, наличие гидроксипролина, хотя последнего в эластине примерно в 10 раз меньше, чем в коллагене. В эластине нет гидроксилизина, но много лизина. При ферментативном гидролизе эластина в гидролизате обнаруживаются десмозин и изодесмозин.
Эти соединения содержатся только в эластине и образуются из боковых цепей (радикалов) остатков лизина. В образовании одной молекулы десмозина или изодесмозина участвуют радикалы четырех остатков лизина, образующие пиридиновое кольцо. Таким путем две, три или четыре полипептидные цепи эластина могут объединяться в системы, способные обратимо растягиваться во всех направлениях. Наряду с десмозином и изодесмозином поперечные связи в молекуле эластина образуется в результате соединения между радикалами аминокислот лизина и норлейцина.
Эластин синтезируется в фибробластах в виде предшественника – тропоэластина (в отличие от проколлагена – проэластина нет). Он растворим и не содержит поперечных связей. В последующем тропоэластин превращается в нерастворимый эластин, содержащий большое количество поперечных связей.
Лизиламинооксидаза снижает при недостатке Cu2+, биосинтез эластина.
Эластические волокна, состоящие из эластина, обладают способностью растягиваться несколько раз в длину, а при снятии нагрузки быстро восстанавливают исходную форму и размер.


 Отдельная
молекула эластина
Отдельная
молекула эластина



















 растяжение
растяжение









 сокращение
сокращение



сшивка
Эластин находится в больших количествах в стенках кровеносных сосудах и в связках. Катаболизм эластина происходит при участии эластазы нейтрофилов. Особое значение это имеет в легких. Поскольку легочная ткань не регенерирует, разрушение эластина в альвеолярных стенках ведет к потере эластичных свойств и развитию энфиземы легких. В норме это не происходит, так как такие протеазы, как эластаза ингибируется белком α-антитрипсином (α-АТ). При дефиците α-АТ, который может быть следствием различных мутаций в гене этого белка, повышается риск развития энфиземы легких. Следует отметить, что в настоящее время этот белок получен методом генной инженерии и используется в профилактике и лечению внутривенным введением.
Протеогликаны образуют межуточное (основное) вещество соединительной ткани, в которое погружены или которым покрыты волокнистые элементы соединительной ткани. Протеогликаны играют роль и межтканевых прослоек и служат смазочным материалом в суставах. Протеогликаны выполняют функцию связывания экстрацеллюлярной воды, а также катионов. Например, они могут фиксировать ионы кальция в очагах оссификации.
Протеогликаны состоят из полисахаридов (примерно 95% молекулы) и белков (примерно 5% молекулы). Гликопротеины состоят из углеводного компонента и белка, но в гликопротеинах преобладает белковый компонент над углеводным.
Полисахаридные цепи протеогликанов называются гликозамингликанами или муко-полисахаридами. Поскольку эти вещества преимущественно обнаруживались в слизистых субстанциях, к названию полисахаридов был добавлен префикс “муко”. Позднее термин “муко-полисахариды” был заменен термином “гликозамингликаны”. Полисахариды, как известно, это полимеры, состоящие из моносахаридов, соединенных гликозидными связями.
Гликозамингликаны представляют собой линейные неразветвленные полимеры, построенные из повторяющихся дисахаридных единиц. Обязательным компонентом дисахаридной единицы является гексозамин, представленный либо глюкозамином, либо галактозамином. Второй главный мономер представлен гексуроновой кислотой или галактозой. Один из сахаров в дисахариде может иметь отрицательно заряженную карбоксильную или фосфатную группу. Тогда гликозамингликаны называются еще кислотными муко-полисахаридами.
Важнейшие гликозамингликаны – это гиалуроновая кислота, хондроитин-4-сульфат, хондроитин-6-сульфат, дерматансульфат, кератансульфат, гепарин, гепаринсульфат.
Гиалуроновая кислота состоит из повторяющихся дисахаридных единиц, состоящих из Д-глюкуроновой кислоты и N-ацетил-Д-глюкозамином. Считают, что основная функция гиалуроновой кислоты в соединительной ткани – связывание воды. Важна также роль гиалуроновой кислоты в регуляции проницаемости тканей.
β-1,4-гликозидную связь между дисахаридными единицами гиалуроновой кислоты гидролизует β-гиалуронидаза (лизосомальный фермент). Гликозидные связи в дисахариде между гиалуроновой кислотой и N-ацетилглюкозамином гидролизует лизосомальный фермент β-глюкозидаза. При расщеплении гиалуроновой кислоты повышается проницаемость тканей.
Хондроитин-4-сульфат и хондроитин-6-сульфат состоят из повторяющихся дисахаридных единиц, представленных глюкуроновой кислотой и N-ацетилгалактозамин-4-сульфата или N-ацетилгалактозамин-6-сульфата (остаток H2SO4 cвязан с 4-ым или с 6-ым углеродным атомом производного галактозамина). Хондроитинсульфаты – основной полисахарид хряща.
Дерматансульфат содержится в значительных количествах в коже.
Кератансульфат впервые был выделен из роговой оболочки глаза, но входит в состав и хрящевой ткани.
Гепарин и гепаринсульфат известны, прежде всего, как антикоагулянты.
Кроме перечисленных протеогликанов, в межклеточном матриксе присутствуют и малые протеогликаны с низкой молекулярной массой. Наиболее изучены декарин, бигликан, фибромодулин, люмикан, перлекан. Это мультифункциональные макромолекулы, которые связываются с другими компонентами соединительной ткани и оказывают влияние на их строение и функции. Декарин и бигликан, присоединялись к фибронектину, подавляют клеточную атгезию, а присоединяясь к фактору роста опухолей β, снижает его фитогенную активность. Углеводные цепочки дерматансульфатов, присоединяющиеся к –ОН- группам серина в N-концевой области богаты остатками сиаловых кислот, как правило N- ацетилнейраминой кислотой (NeuAс). Она представляет собой девятиуглеродный сахар, образованный из маннозамина и пирувата. Такие вещества находятся в плазматических мембранах многих клеток-эритроцитов, гепатоцитов, клеток селезенки и осуществляют межклеточные контакты. Некоторые из них служат своеобразными рецепторами для ряда бактериальных токсинов.
Фибронектин — сложный белок — гликопротеин, имеющий доменную структуру и содержащий несколько активных центров связывания (поливалентный белок). Фибронектин, располагаясь в межклеточном пространстве, участвует в структурной организации взаимодействия в соединительной ткани. При недостаточном биосинтезе фибронектина у онкологических больных происходит метастазирование (распространение) опухоли.
С возрастом в соединительной ткани уменьшается содержание воды и соотношение основное вещество/волокно. Уменьшение этого коэффициента происходит как за счет нарастания содержания коллагена, так и в результате снижения концентрации гликозамингликанов, особенно гиалуроновой кислоты. Происходят также структурные изменения коллагена. В тропоколлагеновых субъединицах и между ними образуется все большее число поперечных связей, что делает фибриллы коллагена в соединительной ткани более жесткими и хрупкими. Увеличивающиеся хрупкость и жесткость коллагена изменяют механические свойства хрящей и сухожилий, делают более ломкими кости, понижают прозрачность роговицы глаза.

 СООН
СН2ОН
СООН
СН2ОН

 Н
Н


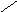





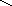

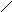 О
Н О
О
Н О
О
 Н Н О
Н Н О


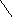




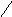 ОН
Н О Н
ОН
Н О Н


 Н НО
Н НО
Н ОН Н NH – CO — CH3 n
Остаток D-глюкороновой Остаток N-ацетилглюкозамина
кислоты
Гиалуроновая кислота
ЛАБОРАТОРНОЕ ЗАНЯТИЕ
Волокнистые структуры
Коллагеновые волокна в рыхлой соединительной ткани располагаются в разных направлениях и имеют вид волнистых, спирально извитых круглых или плоских тяжей толщиной 1 — 10 мкм . Образуют пучки толщиной 150 мкм .
Уровни организации коллагенового волокна
Молекулы коллагена посторены из трех полипептидных цепочек (-цепочек) предшественника коллагена (проколлагена), свивающихся внутри клетки в спираль. Это — первый, молекулярный уровень организации.
Второй, надмолекулярный, внеклеточный уровень представляет собой агрегированные в длину и поперечно связанные водородными связями молекулы коллагена — протофибриллы. Пять-шесть протофибрилл, скрепленные боковыми связями друг с другом, составляют микрофибриллы.
Третий, фибриллярный уровень организации — гликозаминогликаны и гликопротеины окружают пучки микрофибрилл, образуя фибриллы. В фибриллах наблюдается поперечная исчерченность, обусловленная расположением полярных аминокислот во вторичных поперечных связях.
Несколько фибрилл формируют коллагеновое волокно — 4-ый, волоконный уровень организации.
Существуют 12 видов коллагена :
Коллаген I типа — соединительная ткань кожи, кость, роговица глаза, склера, стенка артерий.
Коллаген II типа — гиалиновый и фиброзный хрящи, стекловидное тело.
Коллаген III типа- дерма кожи плода, стенка больших кровеносных сосудов, ретикулярные волокна.
Коллаген IV типа — в базальных мембранах, капсуле хрусталика.
Коллаген V типа — около клеток, которые его синтезируют.
Коллаген VI- VII типов — называют микрофибриллярным
Коллаген VIII- XII типов — в эндотелии, хрящах, стекловидном теле.
Эластические волокна. Их наличие в соединительной ткани обуславливает ее эластичность и растяжимость. Форма волокон округлая или уплощенная.
Строение
Основным структурным компонентом является глобулярный белок — эластин, который синтезируется фибробластами. Молекулы эластина имеют форму глобул диаметром 2,8 нм — первый, молекулярный уровень организации. Вне клетки они соединяются в цепочку толщиной 3 — 3,5 нм, которая называется эластиновой протофибриллой — второй, надмолекулярный уровень, которые в комплексе с гликопротеидами образуют микрофибриллы толщиной 8 — 10 нм — третий, фибриллярный уровень. Эластическое волокно (четвертый, волоконный уровень организации) представляет собой цилиндр, центр которого заполнен аморфным компонентом, а на периферии — “чехол” из микрофиламент.
Разные типы эластических волокон имеют различное их соотношение . Наиболее зрелые содержат около 90% эластина в виде аморфного компонента и всего 10% — в виде фибриллярного компонента. Близкие к зрелым волокнам — называются элауниновые волокна, в которых соотношение этих двух компонентов почти равное. Окситалановые волокна состоят только из микрофибрилл. Поперечная исчерченность в эластических волокнах отсутствует.
Ретикулярные волокна
Относятся к типу коллагеновых, так как в их состав входит коллаген (III типа). Содержат повышенное количество углеводов, которые синтезируются ретикулярными клетками и образуют трехмерную сеть — ретикулум.
Коллагеновые волокна. Образование, строение, свойства, биологическое значение
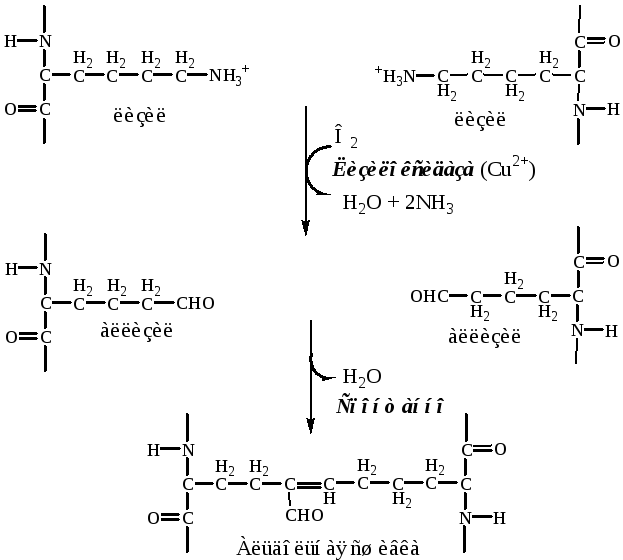
1. Молекулы тропоколлагенаI, II, III типов спонтанно выстраиваются параллельно, со сдвигом на 1/4 относительно друг друга. Концы тропоколлагена располагаются не притык, между ними имеется промежуток в 35—40 нм (в костной ткани в промежутки откладываются кристаллы гидроксиаппатита). Так образуютсямикрофибриллы, которые далее объединяются вфибриллы. Появившиеся фибриллы незрелы, они не обладают механической прочностью.
2. Процесс созревания фибрилл происходит при образовании ковалентных сшивок внутри и между молекулами тропоколлагена.
а). Внеклеточная лизилоксидаза (РР, В6,Cu2+) осуществляет окислительное дезаминирование в некоторых остатках лизина и гидроксилизина с образованием активных альдегидов: аллизина и гидроксиаллизина.
б). активные альдегиды образуют ковалентные связи между собой, а также с другими остатками лизина или гидроксилизина. В результате возникают очень прочные зрелые фибриллы.
3. Далее зрелые фибриллы агрегируют в коллагеновые волокна.
Коллагеновые волокна находятся преимущественно в тканях, которые испытывают значительную механическую нагрузку (кости, сухожилия, хрящи, межпозвоночные диски, кровеносные сосуды), а также входят в состав стромы паренхиматозных органов.
Количество поперечных связей в фибриллах зависит от функции и возраста ткани. Между молекулами тропоколлагена ахиллова сухожилия сшивок особенно много, так как для этой структуры важна большая прочность. С возрастом количество поперечных связей в фибриллах тропоколлагена возрастает, что приводит к замедлению скорости его обмена у пожилых и старых людей.
Сетеподобные структуры. Строение, свойства биологическое значение
Проколлагены IV, VIII, X типов благодаря наличию концевых пропептидов способны образовывать сети.
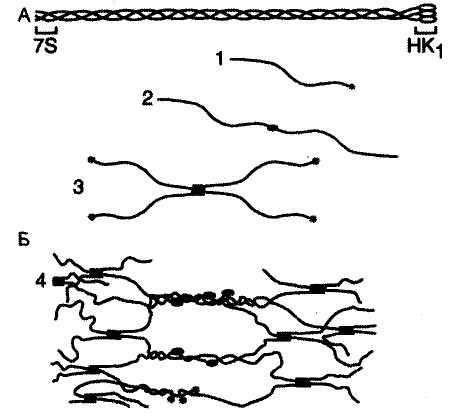
| Организация коллагена IV типа А. Тройная спираль мономера коллагена: 7S — N-конец; НК1— С-конец. Б. Полимеризация коллагена IV типа: 1 — мономер; 2 — димеры, образованные соединением мономеров в области НК1-доменов; 3 — тетрамеры, образованные соединением мономеров в области 7S-сегментов в параллельном и антипараллельном направлениях; 4 — образование сетчатой структуры из олигомерных форм коллагена IV типа. |
Проколлаген IV типаявляется структурным компонентомбазальных мембран, которые представляют собой особую форму межклеточного матрикса. Его секретируют различные типы клеток: эпителиальные, эндотелиальные, мышечные, нервные, жировые.
Особенностью проколлагена IV типа является то, что повторяющиеся спирализованные участки часто прерываются короткими неспиральными сегментами, что увеличивает гибкость коллагена и способствует образованию на его основе сетчатых структур, с гексагональными ячейками размером 170 нм.
Проколлагены VIII и X типовявляются короткоцепочечными (они в 2 раза короче).
Проколлаген VIII типа — компонент десцеметовых мембран эндотелия роговицы. Молекулы этого проколлагена образуют гексагональные решётки, обеспечивающие прозрачность роговицы.
Также проколлаген VIII типа присутствует в кровеносных сосудах, в которых он находится в матриксе под эндотелиальными клетками.
Коллагеновые волокна. Образование, строение, свойства, биологическое значение
1. Молекулы тропоколлагенаI, II, III типов спонтанно выстраиваются параллельно, со сдвигом на 1/4 относительно друг друга. Концы тропоколлагена располагаются не притык, между ними имеется промежуток в 35—40 нм (в костной ткани в промежутки откладываются кристаллы гидроксиаппатита). Так образуютсямикрофибриллы, которые далее объединяются вфибриллы. Появившиеся фибриллы незрелы, они не обладают механической прочностью.
2. Процесс созревания фибрилл происходит при образовании ковалентных сшивок внутри и между молекулами тропоколлагена.
а). Внеклеточная лизилоксидаза (РР, В6,Cu2+) осуществляет окислительное дезаминирование в некоторых остатках лизина и гидроксилизина с образованием активных альдегидов: аллизина и гидроксиаллизина.
б). активные альдегиды образуют ковалентные связи между собой, а также с другими остатками лизина или гидроксилизина. В результате возникают очень прочные зрелые фибриллы.
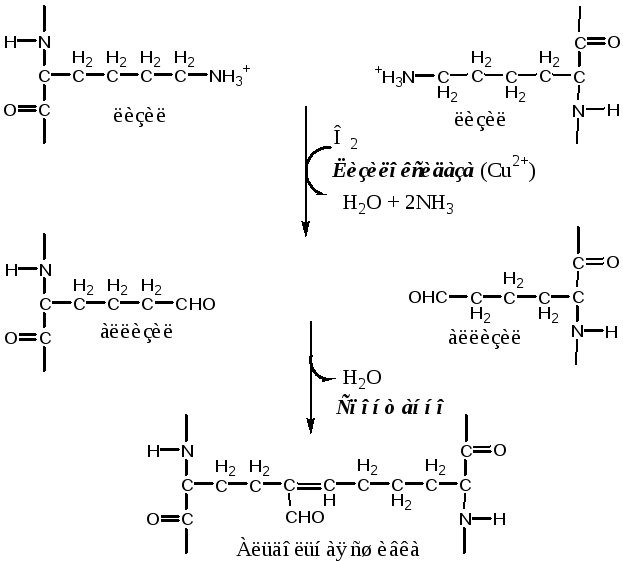

3. Далее зрелые фибриллы агрегируют в коллагеновые волокна.
Коллагеновые волокна находятся преимущественно в тканях, которые испытывают значительную механическую нагрузку (кости, сухожилия, хрящи, межпозвоночные диски, кровеносные сосуды), а также входят в состав стромы паренхиматозных органов.
Количество поперечных связей в фибриллах зависит от функции и возраста ткани. Между молекулами тропоколлагена ахиллова сухожилия сшивок особенно много, так как для этой структуры важна большая прочность. С возрастом количество поперечных связей в фибриллах тропоколлагена возрастает, что приводит к замедлению скорости его обмена у пожилых и старых людей.
Сетеподобные структуры. Строение, свойства биологическое значение
Проколлагены IV, VIII, X типов благодаря наличию концевых пропептидов способны образовывать сети.
| Организация коллагена IV типа А. Тройная спираль мономера коллагена: 7S — N-конец; НК1— С-конец. Б. Полимеризация коллагена IV типа: 1 — мономер; 2 — димеры, образованные соединением мономеров в области НК1-доменов; 3 — тетрамеры, образованные соединением мономеров в области 7S-сегментов в параллельном и антипараллельном направлениях; 4 — образование сетчатой структуры из олигомерных форм коллагена IV типа. |
Проколлаген IV типаявляется структурным компонентомбазальных мембран, которые представляют собой особую форму межклеточного матрикса. Его секретируют различные типы клеток: эпителиальные, эндотелиальные, мышечные, нервные, жировые.
Особенностью проколлагена IV типа является то, что повторяющиеся спирализованные участки часто прерываются короткими неспиральными сегментами, что увеличивает гибкость коллагена и способствует образованию на его основе сетчатых структур, с гексагональными ячейками размером 170 нм.
Проколлагены VIII и X типовявляются короткоцепочечными (они в 2 раза короче).
Проколлаген VIII типа — компонент десцеметовых мембран эндотелия роговицы. Молекулы этого проколлагена образуют гексагональные решётки, обеспечивающие прозрачность роговицы.
Также проколлаген VIII типа присутствует в кровеносных сосудах, в которых он находится в матриксе под эндотелиальными клетками.