Коллаген химическая формула: ХиМиК.ru — КОЛЛАГЕН — Химическая энциклопедия
Коллаген. «БИОЛОГИЧЕСКАЯ ХИМИЯ», Березов Т.Т., Коровкин Б.Ф.
Характерным компонентом структуры соединительной ткани являются коллагеновые волокна. Они построены в основном из своеобразного белкаи – коллагена. Коллаген составляет 25–33% от общего количества белка организма взрослого человека, или 6% от массы тела.
Видимые в
оптическом микроскопе коллагеновые волокна состоят из различимых в электронном
микроскопе фибрилл – вытянутых в длину белковых молекул, названных
тропоколлагеном. Тропоколлаген – основная структурная единица
коллагена (рис. 21.2). Необходимо четко разграничивать понятия «коллагеновые
волокна» и «коллаген». Первое понятие по существу является морфологическим и не
может быть сведено к биохимическим представлениям о коллагене как о белке.
Коллагеновое волокно представляет собой гетерогенное образование и содержит,
кроме белка коллагена, другие химические компоненты. Молекула тропоколла-гена –
это белок коллаген. Одной из отличительных черт данного белка является то, что
Одной из отличительных черт данного белка является то, что
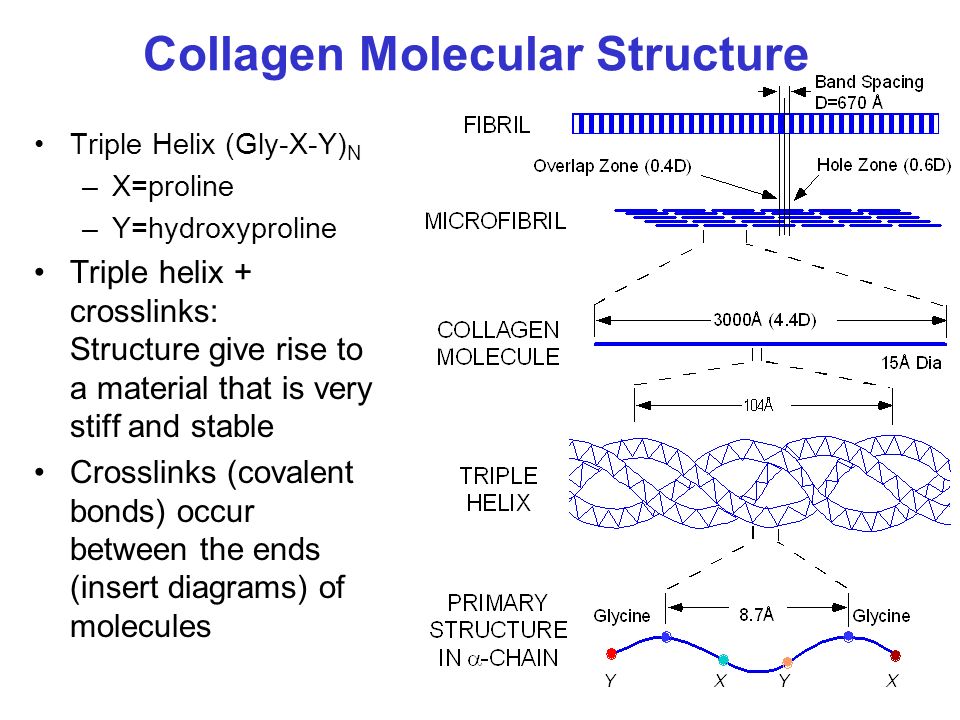
Молекулярная масса тропоколлагена около 285000. Тропоколлаген состоит из трех полипептидных цепей одинакового размера, которые сливаются в спиралевидный триплет. Тройная спираль стабилизируется многочисленными межцепочечными поперечными сшивками между лизи-новыми и гидроксилизиновыми остатками. Каждая полипептидная цепь тропоколлагена содержит около 1000 аминокислотных остатков. Таким образом, основная структурная единица коллагена имеет очень большие размеры, например в 10 раз больше, чем химотрипсин.
Изучение
аминокислотного состава и последовательности чередования аминокислот в
полипептидных цепях тропоколлагена показало, что существует два типа цепей –
цепи α1 и α2, а также четыре
разновидности цепи α1: α1 (I), α1
(II), α1 (III) и α1 (IV). В табл. 21.1
представлены данные о структуре коллагенов различных тканей.
В табл. 21.1
представлены данные о структуре коллагенов различных тканей.
Как и все белки, коллаген синтезируется клетками из свободных аминокислотных остатков. Аминокислотные остатки, специфичные для молекулы коллагена, гидроксипролин и гидроксилизин не образуются из соответствующих свободных аминокислот. Эти аминокислотные остатки появляются после включения пролина и лизина в полипептидную цепь с участием ферментов пролилгидроксилазы или лизилгидроксилазы и кофактора – аскорбиновой кислоты.
Учитывая наличие разных молекулярных форм в пределах одного типа (например, коллаген типа 1 имеет состав [α1 (I)]2 α2 либо [α1 (I)]3, есть основание считать, что существует по крайней мере не менее 10 молекулярных форм коллагена (Е.С. Северин).
Напомним, что
коллаген – внеклеточный белок, но он синтезируется в виде внутриклеточной
молекулы-предшественника, которая перед образованием фибрилл зрелого коллагена
подвергается посттрансляционной модификации. Предшественник коллагена (сначала
препроколлаген, а затем проколлаген) претерпевает процессинг в ходе прохождения
через эндо-плазматический ретикулум и комплекс Гольджи до появления во
внеклеточном пространстве. Внеклеточные амино- и карбоксипротеаза проколлагена удаляют
соответственно аминоконцевой и карбоксиконцевой про-пептиды. Вновь образованные
молекулы коллагена спонтанно собираются в коллагеновые фибриллы. В результате
перекрестного связывания цепей и спиральных молекул фибрилл через основания
Шиффа и альдольную конденсацию (т.е. перекрестное связывание их рядом
ковалентных связей) образовавшиеся фибриллы приобретают силу напряжения зрелых
колла-геновых фибрилл.
Предшественник коллагена (сначала
препроколлаген, а затем проколлаген) претерпевает процессинг в ходе прохождения
через эндо-плазматический ретикулум и комплекс Гольджи до появления во
внеклеточном пространстве. Внеклеточные амино- и карбоксипротеаза проколлагена удаляют
соответственно аминоконцевой и карбоксиконцевой про-пептиды. Вновь образованные
молекулы коллагена спонтанно собираются в коллагеновые фибриллы. В результате
перекрестного связывания цепей и спиральных молекул фибрилл через основания
Шиффа и альдольную конденсацию (т.е. перекрестное связывание их рядом
ковалентных связей) образовавшиеся фибриллы приобретают силу напряжения зрелых
колла-геновых фибрилл.
Предыдущая страница | Следующая страница
СОДЕРЖАНИЕ
Еще по теме:
- КОЛЛАГЕН — химическая энциклопедия
- Коллаген — биохимический справочник
- Коллагены — Наглядная биохимия
- Коллаген — лекарственные препараты
Коллаген в медицинской клинике Атлант https://mc-atlant.
 ru
ruКОЛЛАГЕН ОСНОВНОЙ — НИТЕВИДНЫЙ БЕЛОК
Коллаген является основным компонентом соединительной ткани, включая ткани суставов. Биологическая физиология выработки коллагена в суставе человека связана с процессом синтеза коллагена клетками хряща.
Химический процесс на клеточном уровне начинается с выделения прекурсора коллагена — проколлагена. Проколлаген выделяется из клеток хряща и затем переносится в межклеточное пространство. Здесь происходит последующее сборка молекул коллагена из проколлагена. Этот процесс включает в себя ряд химических реакций, включая гидроксилирование и гликозилирование проколлагена.
Проколлаген — это предшественник коллагена, который содержит трипептидные повторы глицин-ксилин-пролин. Две молекулы проколлагена связываются между собой через края ксилиновых остатков и образуют терминальные пептиды, которые затем удаляются ферментами. Это приводит к образованию коллагеновых молекул, которые состоят из трех спиральных цепей, связанных между собой волокнами.
Химическая формула строения коллагена из проколлагена:
h3N-Gly-Pro-X-Y-Pro-COOH
Где X и Y — это аминокислоты, которые могут быть любыми из 20 возможных аминокислот, но обычно это гидроксипролин и гидроксилизин соответственно.
Кроме того, процесс синтеза коллагена в суставе человека регулируется различными гормонами и факторами роста. Например, гормон роста стимулирует синтез коллагена в хрящевых тканях и ускоряет процесс регенерации тканей. Инсулин-подобный фактор роста (IGF) также стимулирует синтез коллагена и ускоряет процесс регенерации тканей.
Кроме того, важную роль в процессе синтеза коллагена играют витамины и минералы, такие как витамин С, магний и марганец. Витамин С участвует в процессе гидроксилирования проколлагена, а магний и марганец необходимы для синтеза коллагена.
В целом, процесс синтеза коллагена в суставе человека является сложным процессом, который регулируется различными гормонами, факторами роста и питательными веществами. Понимание этого процесса может помочь в разработке эффективных методов лечения заболеваний опорно-двигательного аппарата, связанных с дефицитом коллагена.
Понимание этого процесса может помочь в разработке эффективных методов лечения заболеваний опорно-двигательного аппарата, связанных с дефицитом коллагена.
В организме человека существует более 20 видов коллагена, но наиболее распространены следующие:
-
Тип I – составляет около 90% всех коллагеновых волокон в организме. Он присутствует в коже, костях, сухожилиях и связках, а также в зубах и сосудах.
-
Тип II – составляет основную часть хрящевой ткани, особенно в суставах.
-
Тип III – присутствует в кровеносных сосудах, коже, легких и маточной ткани.
-
Тип IV – составляет основу базальной мембраны, которая разделяет эпителиальные и мезенхимальные ткани.
Химическая формула коллагена: (C₆H₁₀NO₂R)n, где R – это боковая цепь аминокислоты.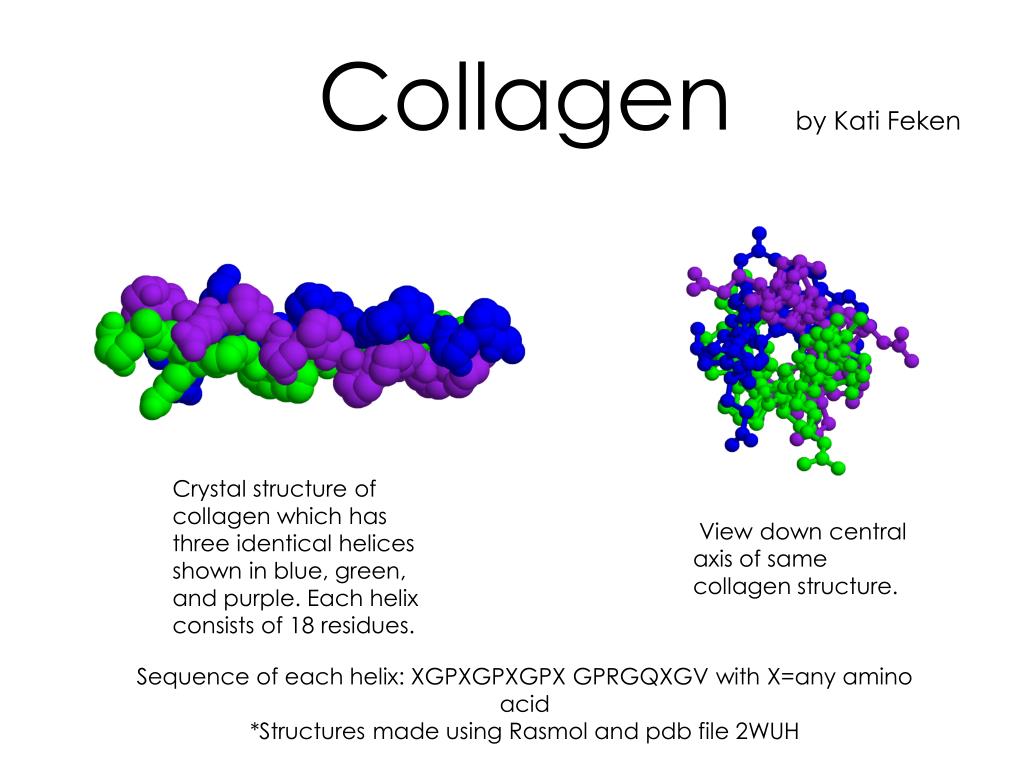
Скорость роста коллагеновых тканей в хряще сустава зависит от многих факторов, включая возраст, наличие травм, общее здоровье и диету. Обычно рост коллагеновых тканей в хряще сустава происходит медленно и может занимать месяцы или даже годы.
Важно
Уважаемые пациенты и гости сайта! Просим Вас писать свои комментарии по поводу данной статьи! Интересно услышать Ваше мнение, понравилась ли вам статья и о чем бы хотели узнать еще?
Коллаген | 9007-34-5
Общее описание
Коллаген (Collagen) является основным компонентом внеклеточного матрикса и в основном представлен в виде нерастворимого фибрина. Он широко представлен в костях животных, сухожилиях, мышцах, связках, фасциях, хрящах и коже и является чрезвычайно важным белком в соединительной ткани, на долю которого приходится от 25% до 30% общего белка тела животного. Его функция — поддерживающий орган и защита тела. Это также самый важный вид белка, находящийся в клеточном матриксе.
Коллаген богат питательными веществами. Помимо того, что он богат триптофаном и цистеином, он также содержит гидроксипролин и пироглутамат, которые редко присутствуют в обычных белках.

1. Помимо цистина и триптофана, коллаген богат 18 видами аминокислот, в том числе семью видами незаменимых аминокислот для человека.
2. Содержание глицина в коллагене составляет почти треть.
3. Коллаген содержит гидроксилизин и гидроксипролин, которых нет в других белках.
Рисунок 1 Состав белков коллагена
Структурные свойства
По молекулярной структуре коллаген состоит из параллельных линейных цепей, каждая линейная цепь состоит из трех скрученных левозакрученных α-пептидных цепей, которые тесно связаны межцепочечными взаимодействиями и объединены в прочную правозакрученную тройную спираль (тройной -спиральная) структура. Каждая α-пептидная цепь состоит из более чем 300 тандемных повторов Gly-X-Y с другими небольшими сегментами другой структуры, соединяющими два конца. Все аминокислотные остатки в коллагене относятся к α-аминокислотам, где X, Y представляет собой любой аминокислотный остаток, отличный от Gly, но обычно для X: Pro; для Y обычно является гидроксипролин (Hyp), который не кодируется основанием ДНК. Гидроксипролин образуется под действием специфического фермента — пролин-4-гидроксилазы (пролил-4-гидроксилазы, Р4Н) на пролин после образования первичной структуры белка. Гидроксигруппы гидроксипролина играют важную роль в стабилизации спиральной структуры коллагена посредством водородных связей. Кроме того, коллаген также содержит определенное количество гидроксилизина (Hyl), который оказывает такое же действие, как Hyp. Поскольку боковые цепи Pro и Hyp кольцеобразные, связи между их α-углеродом и амидным азотом не могут быть повернуты (угол обычно фиксируется на уровне около -60°). Таким образом, высокое содержание этих аминокислотных остатков ускоряет формирование спиральной структуры α-цепи и дополнительно стабилизирует ее. В тройной спирали группа GIy расположена в центре спирали, а остальные аминокислоты, имеющие боковую цепь, расположены вне спирали. Шаг спирали правой тройной спирали составляет 8,55 нм, а ее радиус — 1,5 нм. Каждый круг каждой пептидной цепи содержит 30 остатков; а длина каждой левой спиральной пептидной цепи равна 0,952 нм.
Гидроксипролин образуется под действием специфического фермента — пролин-4-гидроксилазы (пролил-4-гидроксилазы, Р4Н) на пролин после образования первичной структуры белка. Гидроксигруппы гидроксипролина играют важную роль в стабилизации спиральной структуры коллагена посредством водородных связей. Кроме того, коллаген также содержит определенное количество гидроксилизина (Hyl), который оказывает такое же действие, как Hyp. Поскольку боковые цепи Pro и Hyp кольцеобразные, связи между их α-углеродом и амидным азотом не могут быть повернуты (угол обычно фиксируется на уровне около -60°). Таким образом, высокое содержание этих аминокислотных остатков ускоряет формирование спиральной структуры α-цепи и дополнительно стабилизирует ее. В тройной спирали группа GIy расположена в центре спирали, а остальные аминокислоты, имеющие боковую цепь, расположены вне спирали. Шаг спирали правой тройной спирали составляет 8,55 нм, а ее радиус — 1,5 нм. Каждый круг каждой пептидной цепи содержит 30 остатков; а длина каждой левой спиральной пептидной цепи равна 0,952 нм. Каждый круг содержит примерно 3,3 остатка с расстоянием между аксиально соседними аминокислотными остатками, равным 0,286 нм. Поскольку структура тройной спирали представляет собой дислокационную структуру, остатки Gly происходят из трех пептидных цепей, расположенных вдоль центральной оси спирали. В трехмерном пространстве Gly цепи примыкает к остаткам X и Y двух других цепей соответственно. Gly в Китае A близок к остатку X цепи C и остатку Y в цепи B. Следовательно, NH каждого остатка Gly образует водородные связи с CO соседних остатков X. Поскольку гидроксильные остатки Hyp также участвуют в образовании водородных связей между цепями, структура тройной спирали дополнительно стабилизируется и усиливается. Исследования показали, что присутствие ионов двухвалентного железа на N-конце полипептида коллагена может дополнительно улучшить стабильность тройной спиральной структуры. Кроме того, спектры кругового дихроизма показывают, что полигидроксисоединения, такие как сахарные спирты, могут полимеризоваться с коллагенами.
Каждый круг содержит примерно 3,3 остатка с расстоянием между аксиально соседними аминокислотными остатками, равным 0,286 нм. Поскольку структура тройной спирали представляет собой дислокационную структуру, остатки Gly происходят из трех пептидных цепей, расположенных вдоль центральной оси спирали. В трехмерном пространстве Gly цепи примыкает к остаткам X и Y двух других цепей соответственно. Gly в Китае A близок к остатку X цепи C и остатку Y в цепи B. Следовательно, NH каждого остатка Gly образует водородные связи с CO соседних остатков X. Поскольку гидроксильные остатки Hyp также участвуют в образовании водородных связей между цепями, структура тройной спирали дополнительно стабилизируется и усиливается. Исследования показали, что присутствие ионов двухвалентного железа на N-конце полипептида коллагена может дополнительно улучшить стабильность тройной спиральной структуры. Кроме того, спектры кругового дихроизма показывают, что полигидроксисоединения, такие как сахарные спирты, могут полимеризоваться с коллагенами.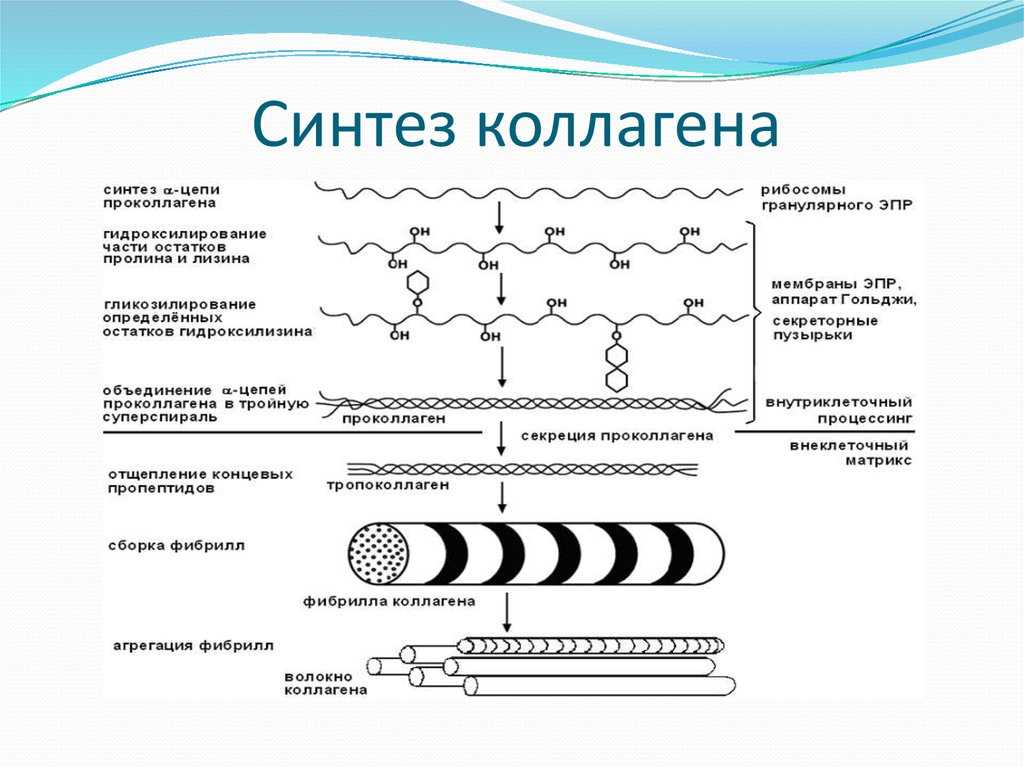 Молекулярно-механические расчеты также показали, что полимеризация обычно происходит в положении, где X представляет собой Ser триплетов коллагена. Однако стабильность коллагена будет ослаблена повышенным содержанием атомов углерода в таких соединениях.
Молекулярно-механические расчеты также показали, что полимеризация обычно происходит в положении, где X представляет собой Ser триплетов коллагена. Однако стабильность коллагена будет ослаблена повышенным содержанием атомов углерода в таких соединениях.
Рисунок 2. Трехмерная структура коллагена
Физические и химические свойства
Коллагеновый белок является амфотерным электролитом, зависит от двух факторов: во-первых, каждая из пептидных цепей коллагена имеет много кислотных или основных боковых групп; Во-вторых, каждый коллаген имеет α-карбоксильные группы и α-аминогруппы на двух концах. Эти группы обладают способностью принимать или отдавать протон. Диссоциирующие группы могут давать как положительный, так и отрицательный заряд в определенном диапазоне pH. Другими словами, разные коллагены становятся ионами с большим количеством положительных или отрицательных зарядов при разном рН среды. ИПК боковой цепи пептида коллагена немного отличается от значения ИПК его боковых групп аминокислот, что связано с влиянием соседнего заряда в молекуле белка. Изоэлектрическая точка коллагена (коровьей кожи) составляет от 7,5 до 7,8, демонстрируя слабощелочную реакцию, поскольку основные аминокислотные пептидные цепи коллагена немного больше, чем кислая аминокислота. Как полимерное соединение коллаген обладает коллоидными свойствами и определенной вязкостью в водном растворе, при этом вязкость наименьшая в изоэлектрической точке. Чем ниже температура, тем больше становится вязкость.
Изоэлектрическая точка коллагена (коровьей кожи) составляет от 7,5 до 7,8, демонстрируя слабощелочную реакцию, поскольку основные аминокислотные пептидные цепи коллагена немного больше, чем кислая аминокислота. Как полимерное соединение коллаген обладает коллоидными свойствами и определенной вязкостью в водном растворе, при этом вязкость наименьшая в изоэлектрической точке. Чем ниже температура, тем больше становится вязкость.
Приведенная выше информация отредактирована Химической книгой Дай Сюнфэна.
Биологические свойства
1. Низкая иммуногенность
Наиболее важным свойством коллагена как медицинского биоматериала является его низкая иммуногенность. Существует три типа антигенных молекул коллагена; первая категория – коллагеновые телопептиды неспиральных пептидных цепей; вторая — конформация тройной спирали коллагена, а третья категория — аминокислотная последовательность а-спиральной области; при этом второй вид антигена представлен только в молекуле природного коллагена; антиген третьего типа существует только в денатурированном коллагене; Фактор антигенов первого класса I представлен как в нативном, так и в денатурированном коллагене.
2. Биосовместимость
Хорошая биосовместимость относится к хорошему взаимодействию между коллагеном и клетками и тканями хозяина. Будь то основа новой организации перед поглощением или ассимиляция в хозяине, чтобы стать его частью, коллаген всегда хорошо взаимодействует с окружающей его матрицей, что демонстрирует координацию взаимодействия друг с другом. Более того, он станет составной частью нормальной физиологической функции клеток и тканей.
3. Биоразлагаемость
Коллаген может быть расщеплен специфическими протеазами. Это означает, что он биоразлагаем. Поскольку коллаген имеет плотную и стабильную спиральную структуру, подавляющее большинство протеаз может расщеплять только его боковые цепи. Только с помощью специфических протеаз при определенных условиях можно разорвать пептидные связи коллагена. Как только пептидные связи коллагена были разорваны, его спиральная структура немедленно разрушается, при этом разорванный полипептид коллагена полностью расщепляется протеазой.
Использование
1. Применение в сфере здравоохранения
Коллаген в основном используется в качестве каркаса, кожи и костей в тканевой инженерии. С применением коллагена в тканевой инженерии изучение биологических мембран также становится более обширным, например, сосудистых мембран, связок и сердечных клапанов. Коллаген
обладает хорошей биосовместимостью и биоразлагаемой безопасностью. Он может разлагаться и поглощаться, обладает хорошей силой адгезии, таким образом, обладая уникальной функцией восстановления кожи, которую можно использовать для трансплантации кожи после модификации. Коллаген может образовывать скелет внеклеточного матрикса и является важным компонентом клеток. Он играет роль закрепления и поддержки клеток, а также обеспечения соответствующей микросреды для пролиферации и роста клеток, а также обеспечивает хорошее снабжение питательными веществами. Таким образом, будь то основа новой организации перед поглощением или ассимиляция в хозяине, чтобы стать его частью, коллаген всегда хорошо взаимодействует с окружающей его матрицей, что демонстрирует координацию взаимодействия друг с другом.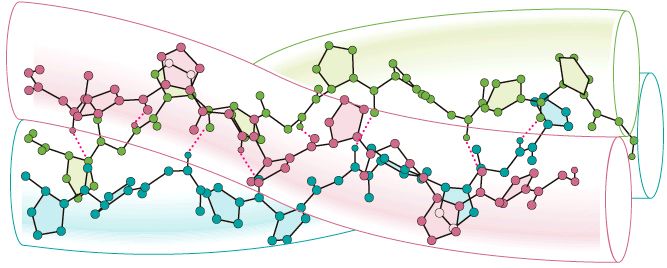 Это повысит нормальную пролиферацию и восстановление эпителиальных клеток, тем самым ускорив заживление раны. В этом случае его применяют для лечения ожогов и травм, лечения и ухода, уменьшения и облегчения степени ожогов. Коллагеновая биологическая повязка имеет два преимущества: во-первых, метод приготовления прост, удобен для стерилизации и обработки; второй обладает хорошей адгезией, подходит для образования грануляционной ткани и клеток эпителия; может уменьшать контрактуру и антигенный ответ ран, обладая хорошим кровоостанавливающим действием и легко рассасывая тканевые экссудаты.
Это повысит нормальную пролиферацию и восстановление эпителиальных клеток, тем самым ускорив заживление раны. В этом случае его применяют для лечения ожогов и травм, лечения и ухода, уменьшения и облегчения степени ожогов. Коллагеновая биологическая повязка имеет два преимущества: во-первых, метод приготовления прост, удобен для стерилизации и обработки; второй обладает хорошей адгезией, подходит для образования грануляционной ткани и клеток эпителия; может уменьшать контрактуру и антигенный ответ ран, обладая хорошим кровоостанавливающим действием и легко рассасывая тканевые экссудаты.
Благодаря своим уникальным свойствам белок коллаген также можно использовать для лечения офтальмологических заболеваний. Коллаген может способствовать росту клеток и восстановлению повреждений эпителиальных клеток роговицы, а также может растворяться в слезах. Он также обладает способностью внедрять клетки эпителия в область дефекта. В то же время его деградированные продукты могут быть использованы новыми клетками для синтеза нового коллагена, который играет роль соединения разных клеток. Таким образом, он широко применяется при лечении глазных заболеваний. Коллаген также может быть использован в качестве носителя для глазного введения с функцией увеличения концентрации лекарственного средства, продления времени действия лекарственного средства и снижения системной токсичности лекарственного средства, что имеет широкие перспективы для развития.
Таким образом, он широко применяется при лечении глазных заболеваний. Коллаген также может быть использован в качестве носителя для глазного введения с функцией увеличения концентрации лекарственного средства, продления времени действия лекарственного средства и снижения системной токсичности лекарственного средства, что имеет широкие перспективы для развития.
В клинической медицине коллаген также широко используется для косметического и ортопедического лечения, для лечения заболеваний пародонта, для восстановления твердых тканей, для восстановления и регенерации нервов, в качестве оберточных материалов для восстановления периодонтального нерва, в качестве искусственных органов, в качестве кардиостимуляторов и пломбировочные материалы органов человека.
2. Применение в косметике
Коллаген может быть извлечен из кожи животных, которая также содержит некоторые протеогликаны, такие как гиалуроновая кислота, хондроитинсульфат, в дополнение к коллагену, которые все относятся к естественному увлажняющему фактору и являются важными материалами для поддержания влажности кожи. Кроме того, он также предотвращает превращение тирозина в меланин в коже. Коллаген, сходный со структурой коллагена в коже, а также в роговом слое, который способствует пролиферации и восстановлению эпителиальных клеток и пополняет аминокислоты и другие питательные вещества, улучшает среду обитания клеток кожи, способствует метаболизму кожи и улучшает кровообращение, заполняет и восстанавливает поврежденную и стареющую кожу, а также обладает хорошей совместимостью, сродством и проницаемостью с кожей. Он может полностью впитываться кожей и делать кожу более упругой, растягивать морщины, повышая плотность кожи и вызывая напряжение. Таким образом, коллаген обладает естественным эффектом увлажнения, отбеливания, устранения веснушек и морщин и, таким образом, широко используется в косметической промышленности. В настоящее время на рынке многие продаваемые косметические средства, такие как маски, кремы для глаз, кремы для кожи, содержат коллаген.
Кроме того, он также предотвращает превращение тирозина в меланин в коже. Коллаген, сходный со структурой коллагена в коже, а также в роговом слое, который способствует пролиферации и восстановлению эпителиальных клеток и пополняет аминокислоты и другие питательные вещества, улучшает среду обитания клеток кожи, способствует метаболизму кожи и улучшает кровообращение, заполняет и восстанавливает поврежденную и стареющую кожу, а также обладает хорошей совместимостью, сродством и проницаемостью с кожей. Он может полностью впитываться кожей и делать кожу более упругой, растягивать морщины, повышая плотность кожи и вызывая напряжение. Таким образом, коллаген обладает естественным эффектом увлажнения, отбеливания, устранения веснушек и морщин и, таким образом, широко используется в косметической промышленности. В настоящее время на рынке многие продаваемые косметические средства, такие как маски, кремы для глаз, кремы для кожи, содержат коллаген.
3. Применение в пищевой промышленности
Существует два аспекта применения коллагена в пищевой промышленности: его функция и питание соответственно. Коллагеновые пептиды можно принимать непосредственно в виде функциональной пищи, такой как жевательные таблетки, протеиновые порошки или энтеральные питательные вещества, желательные для спортсменов. Продукты, богатые коллагеном, могут не только эффективно замедлять старение организма, укреплять глютен и кости, улучшать физическую форму, но также снижать вес и кровяное давление, а также иметь другие последствия для здоровья, такие как пополнение запасов кальция. Обработка коллагена специфическим ферментом может разрушить межмолекулярные водородные связи и еще больше разрушить исходную компактную сверхспиральную структуру. Полученная структура представляет собой более рыхлые небольшие молекулы, добавление которых к мясным продуктам может улучшить состояние соединительной ткани, увеличить содержание белка, а также иметь хороший вкус и питательную ценность. Продукты гидролиза коллагена могут быть использованы в качестве модификатора замороженных пищевых продуктов для использования в качестве загустителя и имеют низкую температуру плавления, легко растворяются сразу после попадания в рот.
Коллагеновые пептиды можно принимать непосредственно в виде функциональной пищи, такой как жевательные таблетки, протеиновые порошки или энтеральные питательные вещества, желательные для спортсменов. Продукты, богатые коллагеном, могут не только эффективно замедлять старение организма, укреплять глютен и кости, улучшать физическую форму, но также снижать вес и кровяное давление, а также иметь другие последствия для здоровья, такие как пополнение запасов кальция. Обработка коллагена специфическим ферментом может разрушить межмолекулярные водородные связи и еще больше разрушить исходную компактную сверхспиральную структуру. Полученная структура представляет собой более рыхлые небольшие молекулы, добавление которых к мясным продуктам может улучшить состояние соединительной ткани, увеличить содержание белка, а также иметь хороший вкус и питательную ценность. Продукты гидролиза коллагена могут быть использованы в качестве модификатора замороженных пищевых продуктов для использования в качестве загустителя и имеют низкую температуру плавления, легко растворяются сразу после попадания в рот. Поэтому коллаген широко используется в желе, кислом сыре, ветчине, консервах, хлебе. Кроме того, благодаря пленкообразующему свойству коллаген может быть мембранным материалом для затвердевания и этикетки мяса. Коллаген также можно использовать в качестве пищевого клея для синтеза пленки и в качестве защитного слоя пищевых продуктов, таких как мясо и рыба, который обладает антиоксидантной активностью, сохраняя при этом яркий цвет мяса.
Поэтому коллаген широко используется в желе, кислом сыре, ветчине, консервах, хлебе. Кроме того, благодаря пленкообразующему свойству коллаген может быть мембранным материалом для затвердевания и этикетки мяса. Коллаген также можно использовать в качестве пищевого клея для синтеза пленки и в качестве защитного слоя пищевых продуктов, таких как мясо и рыба, который обладает антиоксидантной активностью, сохраняя при этом яркий цвет мяса.
4. Применение в других областях
С непрерывными исследованиями коллагена появляется все больше случаев и многообещающих перспектив применения коллагена в других областях. Например, извлечение коллагена, богатого остаточными отходами процесса дубления, может сделать коллаген белковым ресурсом для кормления животных, что реализует использование ресурсов. После денатурации коллагена мы можем улучшить его текстильные свойства и применить в текстильной промышленности. В последние годы появляется все больше и больше случаев применения коллагена в легкой промышленности, такой как бумажная промышленность, кожевенная промышленность и бытовая химическая промышленность. С непрерывным развитием и прогрессом методов исследования становится ясно, что коллаген будет иметь более широкое применение.
С непрерывным развитием и прогрессом методов исследования становится ясно, что коллаген будет иметь более широкое применение.
Химические свойства
Желтоватые хлопья лиофилизированного вещества; Это основной компонент кожи, соединительной ткани, костей и зубов. Различные источники коллагена имеют разные типы, но все они содержат три α-цепи и имеют трехспиральную конформацию. Небольшая разница в первичной структуре приводит к образованию разных типов коллагена. Денатурированный коллаген называют желатином.
Использование
Хирургические шовные волокна; в качестве субстрата для измерения коллагена.
Синтетический метод
В качестве сырья используйте бычьи сухожилия. Извлеките его раствором гидрофосфата натрия и раствором KCl. Остаток промывают, обезвоживают и сушат до получения готового продукта.
Химические свойства
тип В
Использование
для связывания коллагеназы
Использование
подавляют канцерогенез
Использование
Коллаген ахиллова сухожилия крупного рогатого скота подходит для адгезии клеток в культуре тканей, а также для образования геля, агрегации тромбоцитов и в качестве субстрата для коллагеназы. Он также используется в качестве субстрата для клеточных культур, адгезии. Он также используется в качестве фактора прикрепления для первичных культур эпителиоидных клеток.
Определение
Белок соединительной ткани, составляющий примерно 30% общего белка организма, из которого образуются ткани.
Общее описание
Коллаген типа I является компонентом кожи, костей, сухожилий и других волокнистых соединительных тканей. Он состоит из повторяющихся триплетов аминокислот глицина, пролина и гидроксипролина. Коллаген представляет собой левостороннюю спираль с тремя полипептидными цепями. Он является компонентом внеклеточного матрикса, и у крупного рогатого скота присутствует около 28 типов.
Он состоит из повторяющихся триплетов аминокислот глицина, пролина и гидроксипролина. Коллаген представляет собой левостороннюю спираль с тремя полипептидными цепями. Он является компонентом внеклеточного матрикса, и у крупного рогатого скота присутствует около 28 типов.
Биохим/физиол Действия
Коллаген необходим для механической целостности сухожилий и костей. Коллаген сухожилий крысиного хвоста используется в тканевой инженерии, особенно при создании гелей на основе трехмерных каркасов. Он имеет низкую антигенность и совместим с фибробластами десен человека и кератиноцитами ротовой полости человека.
Показаны соединения коллагена (FDB009222) — FooDB
Назад к соединениям
| Информация о записи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Версия | 1.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дата создания | 08.04.2010 22:08:28 UTC | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дата обновления | 28-05-2018 23:21 :52 UTC | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Первичный идентификатор | FDB009222 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дополнительные регистрационные номера | Недоступно | Химическая информация | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Название FooDB | Коллаген | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Описание | 81081-59-6, также известный как AT-CDOP, принадлежит к классу органических соединений, известных как олигопептиды. Это органические соединения, содержащие последовательность от трех до десяти альфа-аминокислот, соединенных пептидными связями. На основании обзора литературы по телефону 81081-59-6 было опубликовано очень мало статей. Это органические соединения, содержащие последовательность от трех до десяти альфа-аминокислот, соединенных пептидными связями. На основании обзора литературы по телефону 81081-59-6 было опубликовано очень мало статей. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 9007-34-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Структура | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Синонимы |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Прогнозируемые свойства |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химическая формула | C36H60N10O11 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Название IUPAC | (2S)-6-амино-2-({[(2S)-1-[2-({[(2S)-1-[(2S)-4-карбокси -2-{[2-({[(2S)-1-[(2S)-2,6-диаминогексаноил]пирролидин-2-ил](гидрокси)метилиден}амино)-1-гидроксиэтилиден]амино}бутаноил]пирролидин -2-ил](гидрокси)метилиден}амино)ацетил]пирролидин-2-ил](гидрокси)метилиден}амино)гексановая кислота | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор InChI | InChI=1S/C36H60N10O11/c37-15-3-1 -8-22(39)34(54)45-18-6-10-25(45)31(51)40-20-28(47)42-23(13-14-30(49))50)35(55)46-19-7-11-26(46)32(52)41-21-29(48)44-17-5-12-27(44)33(53)43-24 (36(56)57)9-2-4-16-38/h32-27H,1-21,37-39h3,(H,40,51)(H,41,52)(H,42,47) (H,43,53)(H,49,50)(H,56,57)/t22-,23-,24-,25-,26-,27-/m0/s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ключ ИнЧИ | ZABMJSAHPWHMNM-QCOJBMJGSA-N | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изомерные SMILES | [H][C@](N)(CCCCN)C(=O)N1CCC[C@@]1([H])C(O)=NCC (O)=N[C@@]([H])(CCC(O)=O)C(=O)N1CCC[C@@]1([H])C(O)=NCC(=O) N1CCC[C@@]1([H])C(O)=N[C@@]([H])(CCCCN)C(O)=O | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Средняя молекулярная масса | 808,935 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Моноизотопная молекулярная масса | 808. 444302792 444302792 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Классификация 9 0109 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Описание | Относится к классу органических соединений, известных как олигопептиды. Это органические соединения, содержащие последовательность от трех до десяти альфа-аминокислот, соединенных пептидными связями. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Королевство | Органические соединения | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Суперкласс | Органические кислоты и производные | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Класс | Карбоновые кислоты и производные | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Подкласс | Аминокислоты, пептиды и аналоги | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Прямой Родитель | Олигопептиды | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Альтернатива Родители |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Заместители |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молекулярный каркас | Алифатические гетеромоноциклические соединения | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние дескрипторы | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Онтология | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Онтология | Термин без онтологии | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физико-химические свойства — Экспериментальный | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физико-химические свойства — Экспериментальный |
| 901 10||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EI-MS/GC-MS | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| МС/МС |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ЯМР | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние ссылки | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChemSpider ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChemBL ID | 9011 4 Недоступно|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор соединения KEGG | C00211 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор соединения Pubchem | 133604 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pubchem Substance ID | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ЧЭБИ ID | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phenol-Explorer ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор DrugBank | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| HMDB ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C RC/DFC (Словарь пищевых соединений) ID | Отсутствует | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EAFUS ID | 740 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dr. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 3
3 08.2016
08.2016 08.2016
08.2016