Коллаген википедия: Коллаген (желатин) для суставов и связок — SportWiki энциклопедия – Коллаген — виды и свойства коллагена
Коллаген — виды и свойства коллагена
Коллаген (collagen) – это фибриллярный белок, является базовым компонентом соединительных тканей организма (находится в костях, сухожилиях, дерме, хрящах и других тканях). Это наиболее распространенный протеин млекопитающих. Коллаген составляет около 25-35 % полипептидов во всем организме. Его обнаружили в организме многоклеточных животных, при этом он отсутствует у простейших, вирусов, бактерий, грибов и растений. Этот белок обеспечивает упругость и эластичность тканей. Благодаря своим свойствам, коллаген является компонентом множества косметических средств, используется в пищевой промышленности и медицине.
Структура и свойства
Молекула коллагена – это закрученная в правую сторону спираль, состоящая из 3-х альфа-цепей. Данное образование также именуется тропоколлагеном. Виток спирали альфа-цепи состоит из 3-х аминокислотных остатков. Коллаген имеет молекулярную массу приблизительно 300 кДа, толщину 1,5 нанометров и протяженность 300 нанометров. Изначальная структура коллагена характеризуется большим содержанием глицина, малым содержанием аминокислот, содержащих серу, и отсутствием триптофана. Этот белок относится к немногим белкам с животным происхождением, которые имеют остаток нестандартных аминокислот (приблизительно 21 % остатка составляют 5-гидроксилизин, 4-гидроксипролин, а также 3- гидроксипролин). Каждая альфа-цепь образуется триадами аминокислот. В этих триадах глицин является всегда третьей аминокислотой, лизин или пролин – второй, любая иная аминокислота кроме вышеуказанных трех – третьей.Полукристаллическая коллагеновая фибрилла является структурной единицей коллагена. Пучки фибрилл образуют коллагеновые волокна.
Существует несколько форм коллагена, основная их структура является схожей. Волокна коллагена возникают в связи с агрегацией микрофибрилл, имеют зеленый или голубой цвет при разнообразных треххромных окрасках, и розовый после окраски гематоксилином. В случае импрегнации серебром коллагеновые волокна приобретают буро-желтую окраску.
Макромолекула коллагена денатурируется приблизительно при температуре фибриллогенеза. В связи с данным свойством, она очень чувствительна к мутации. После денатурации коллагена возникает желатин.
Виды коллагена
На данный момент существует описание двадцати восьми типов коллагена, кодируемых при помощи более чем сорока генов. Данные типы имеют отличия по степени их модификации (интенсивности гликозилирования или гидроксилирования), а также по последовательности аминокислот. Для всех видов коллагенов общим является наличие одного или больше доменов белка, которые содержат тройную спираль, а также их присутствие во внеклеточных структурах ткани. Более девяноста процентов всех коллагенов высших организмов составляют коллагены IV, III, II и I типов.
Существуют следующие разновидности коллагена и их типы:
- фибриллярные коллагены – типы I, ІІ, ІІ, V, ХІ, XXIV, XXVII;
- (FACIT) фибрилл-ассоциированные коллагены – типы ІХ, ХІІ, XIV, XVI, ХІХ, ХХ, ХХІ, XXII;
- коллагены, которые формируют филаменты-бусины — тип VI;
- коллаген, который формирует якорные фибриллы — тип VII;
- сетеобразующий коллаген – типы IV, VIII, Х;
- трансмембранный коллаген – типы ХІІІ, XVII, ХХІІІ, XXV/CLAC-P;
- иные коллагены – типы XV, XVIII, XXVIII.
Коллаген типа I – это тримерный белок, который собирается без разрывов в тройную спираль, самостоятельно собирается в фибриллы и имеет самую высокую механическую прочностью. Иные типы коллагенов имеют отличия в единственном или же нескольких аспектах. Так, некоторые коллагены не обязательно образуют фибриллы или имеют разрывы в спирали.
Медицинские аспекты
Коллаген вместе с другим белком, эластином, образуют своеобразную «основу» кожного покрова, которая придает ему упругость и эластичность, а также предотвращает обвисание кожи. С возрастом выработка как эластина, так и коллагена прекращается, после чего кожа начинает стареть.
Заболевания, которые вызываются дефектами биосинтеза коллагена (в т.ч. так именуемые коллагенозы) могут возникнуть в связи с множеством причин. Это могут быть мутации гена, который кодирует последовательность аминокислот в ферментах, вырабатывающих коллаген, что причиняет к модификацию формы молекулы коллагена. Также заболевания могут причиняться «неправильной работой» или нехваткой ферментов, необходимых для биосинтеза коллагена, дефицитом меди, аскорбиновой кислоты и витаминов B6. При приобретенных заболеваниях, например, при цинге, восстановление нормального баланса ферментов может повлечь за собой полное излечение.
Использование в косметологии
Во множество косметических средств включают коллаген, в связи со следующими его свойствами:
- пролонгирует действие масел, экстрактов и т.п. в составе некоторых косметических композиций;
- образовывает слой на поверхности кожного покрова, который удерживает влагу и имеет разглаживающие свойства;
- придает волосам блеск и создает на их поверхности защитный слой.
Стимуляция выработки коллагена в организме достигается при помощи введения косметических препаратов на базе гиалуроновой кислоты, влияния аппаратного массажа, а также благодаря процедурам лазерного воздействия и контурной пластики.
Коллаген — Википедия. Что такое Коллаген
Коллаген — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у многоклеточных животных; отсутствует у растений, бактерий, вирусов, простейших и грибов[1]. Коллаген — основной компонент соединительной ткани и самый распространённый белок у млекопитающих
История исследования
Учёные десятилетиями не могли понять молекулярное строение коллагена. Первое доказательство того, что коллаген имеет постоянное строение на молекулярном уровне, было представлено в середине 1930-х годов. С того времени много выдающихся учёных, включая Нобелевских лауреатов, таких как Фрэнсис Крик, Лайнус Полинг, Александр Рич, Ада Йонат, Хелен Берман, Вилеайнур Рамачандран, работали над строением мономера коллагена.
Несколько противоречащих друг другу моделей (несмотря на известное строение каждой отдельной пептидной цепи) дали дорогу для создания троично-спиральной модели, объяснившей четвертичное строение молекулы коллагена.
Свойства
Продуктом денатурации коллагена является желатин. Температура денатурации макромолекулы коллагена близка к температуре фибриллогенеза. Это свойство молекулы коллагена делает её максимально чувствительной к мутационным заменам.
Структура
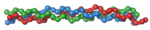
Молекула коллагена представляет собой левозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген[3]. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм.
Для первичной структуры белка характерно высокое содержание глицина, низкое содержание серосодержащих аминокислот и отсутствие триптофана. Коллаген относится к тем немногим белкам животного происхождения, которые содержат остатки нестандартных аминокислот: около 21 % от общего числа остатков приходится на 3-гидроксипролин, 4-гидроксипролин и 5-гидроксилизин[4]. Каждая из α-цепей состоит из триад аминокислот. В триадах третья аминокислота всегда глицин, вторая — пролин или лизин, первая — любая другая аминокислота, кроме трёх перечисленных[3].
Коллаген существует в нескольких формах. Основа строения всех видов коллагена является схожей. Коллагеновые волокна образуются путём агрегации микрофибрилл, имеют розовый цвет при окраске гематоксилином и эозином и голубой или зелёный при различных трёххромных окрасках, при импрегнации серебром окрашиваются в буро-жёлтый цвет.
Фибриллярная структура
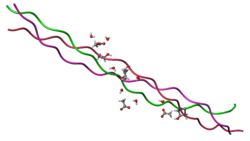
Тропоколлагены (структурные единицы коллагена) спонтанно объединяются, прикрепляясь друг к другу смещенными на определённое расстояние концами, образуя в межклеточном веществе более крупные структуры. В фибриллярных коллагенах молекулы смещены относительно друг друга примерно на 67нм (единица, которая обозначается буквой «D» и меняется в зависимости от состояния гидратации вещества). В целом каждый D-период содержит четыре целых и часть пятой молекулы коллагена. Величина 300 нм, поделенная на 67 нм (300:67) не дают целого числа и длина молекулы коллагена разделена на непостоянные по величине отрезки D. Следовательно, в разрезе каждого повтора D-периода микрофибриллы есть часть, состоящая из пяти молекул, называемая «перекрытие», и часть, состоящая из четырёх молекул — «разрыв». Тропоколлагены к тому же скомпонованы в шестиугольную или псевдошестиугольную (в поперечном разрезе) конструкцию, в каждой области «перекрытия» и «разрыва».
Внутри тропоколлагенов существует ковалентная связь между цепями, а также некоторое непостоянное количество данных связей между самими тропоколагеновыми спиралями, образующими хорошо организованные структуры (например, фибриллы). Более толстые пучки фибрилл формируются с помощью белков нескольких других классов, включая другие типы коллагенов, гликопротеины, протеогликаны, использующихся для формирования различных типов тканей из разных комбинаций одних и тех же основных белков. Нерастворимость коллагена была препятствием к изучению мономера коллагена, до того момента как было обнаружено, что возможно извлечь тропоколлаген молодого животного, поскольку он ещё не образовал сильных связей с другими субъединицами фибриллы. Тем не менее, усовершенствование микроскопов и рентгеновских аппаратов облегчили исследования, появлялось все больше подробных изображений структуры молекулы коллагена. Эти поздние открытия очень важны для лучшего понимания того, как структура коллагена влияет на связи между клетками и межклеточным веществом, как ткани меняются во время роста и регенерации, как они меняются во время эмбрионального развития и при патологии.
Коллагеновая фибрилла — это полукристаллическая структурная единица коллагена. Коллагеновые волокна — это пучки фибрилл.
Использование
Пищевая промышленность
С точки зрения питания, коллаген и желатин являются белками низкого качества, так как они не содержат всех незаменимых аминокислот, необходимых человеку — это неполноценные белки. Производители основанных на коллагене пищевых добавок утверждают, что их продукты могут улучшить качество кожи и ногтей, а также здоровье суставов[источник не указан 3056 дней].
Относительно дешёвые, часто предлагаемые сегодня на рынке под видом источника свободных аминокислот гидролизаты коллагена не всегда способны удовлетворить потребности человека в свободных аминокислотах, так как эти продукты не содержат готовые к усвоению аминокислоты, а являются лишь частично «переваренными» экстрактами суставных тканей млекопитающих, птиц или обитателей моря. Например, гидролизаты коллагена почти полностью лишены аминокислоты L-глютамина, не отличающейся стойкостью к термическому воздействию и долгому хранению сырья, большая часть глютамина разрушается уже на первых этапах хранения и переработки сырья, имеющийся небольшой остаток практически полностью распадается во время термической экстракции хрящевой ткани.
Наиболее качественными источниками аминокислот являются препараты, содержащие так называемые «свободные аминокислоты». Так как именно свободные аминокислоты являются практически готовыми к усвоению, организму не нужно тратить пищеварительные ферменты, время и энергию на их переваривание. Они способны в кратчайшие сроки поступить в кровь и, будучи доставленными ею к местам, нуждающимся в дополнительном синтезе коллагена, тут же включаются в его формирование[источник не указан 2792 дня].
Косметические средства
Коллаген входит в состав косметических средств для :
- Образования воздухопроницаемого, влагоудерживающего слоя на поверхности кожи, обладающего пластифицирующими (разглаживающими) свойствами, со свойствами влажного компресса;
- Продления действия экстрактов, масел и др. в составе косметических композиций;
- Придания блеска волосам, создания коллагенового (защитного) слоя на поверхности волос.
Научные исследования
В 2005 году учёным удалось выделить коллаген из сохранившихся мягких тканей тираннозавра[5][нет в источнике] и использовать его химический состав как ещё одно доказательство родства динозавров с современными птицами[6].
Научные исследования в медицине
Синтез коллагена — сложный ферментативный многостадийный процесс, который должен быть обеспечен достаточным количеством витаминов и минеральных элементов. Синтез протекает в фибробласте и ряд стадий вне фибробласта. Важный момент в синтезе — реакции гидроксилирования, которые открывают путь дальнейшим модификациям, необходимым для созревания коллагена. Катализируют реакции гидроксилирования специфические ферменты. Так, образование 4-оксипролина катализирует пролингидроксилаза, в активном центре которой находится железо. Фермент активен в том случае, если железо находится в двухвалентной форме, что обеспечивается аскорбиновой кислотой (витамин С). Дефицит аскорбиновой кислоты нарушает процесс гидроксилирования, что влияет на дальнейшие стадии синтеза коллагена: гликозилирование, отщепление N- и С-концевых пептидов и др. В результате синтезируется аномальный коллаген, более рыхлый. Эти изменения лежат в основе развития цинги. Коллаген и эластин формируют своеобразную «основу» кожи, которая предотвращает её обвисание, обеспечивает её эластичность и упругость. Эластин как белок прекращает выработку ферментов в человеческом организме в 14 лет, а коллаген — в 21—25, после чего кожные покровы не восстанавливаются и кожа стареет. Также важнейшим компонентом соединительной ткани является кератин — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога, перья и др.
Фотография
Белок является основой для фотографической желатины, которая вместе с микрокристаллами галогенидов серебра образует фотографическую эмульсию. При получении фотографической желатины коллаген денатурируют кислотой или щёлочью. Фотографическая эмульсия, нанесённая тонким слоем на целлулоидную плёнку, стекло или бумагу, а затем высушенная, — это и есть светочувствительный слой фотоматериала (например, фотоплёнки).
Типы коллагена
В настоящее время описано 28 типов коллагена, которые кодируются более чем 40 генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации — интенсивности гидроксилирования или гликозилирования. Общим для всех коллагенов является существование 1 или более доменов, содержащих тройную спираль и присутствие их во внеклеточном матриксе. Более 90 % всего коллагена высших организмов приходится на коллагены I, II,III и IV типов.
| Разновидности коллагена | Типы |
|---|---|
| Фибриллярные коллагены | I, II, III, V, XI, XXIV, XXVII |
| Фибрилл-ассоциированные коллагены (FACIT) | IX, XII, XIV, XVI, XIX, XX, XXI, XXII |
| Коллагены, формирующие филаменты- бусины (beaded filament forming) | VI |
| Сетеобразующие коллагены | IV, VIII, X |
| Коллаген, формирующий якорные фибриллы | VII |
| Трансмембранные коллагены | XIII, XVII, XXIII, XXV/CLAC-P |
| Другие коллагены | XXVIII, XV, XVIII |
Кроме коллагеновых белков существует множество других белков, содержащих в своей структуре домен с тройной коллагеновой спиралью[7][8]. И, тем не менее, их не причисляют к коллагенам, а только к «коллагеноподобным». К большой группе коллагеноподобных белков относятся подкомпонент C1q-комплемента, C1q-подобный фактор, адипонектин, колектины и фиколины, концевая структура ацетилхолинестаразы, три макрофаговых рецептора, эктодисплазин и EMILIN. Эти белки, так же как и коллагены, играют структурную и регуляторную роль.
Коллаген первого типа, самый архетипичный, является тримерным белком, собирающимся в тройные спирали без разрывов, самособирающимся в фибриллы и обладающим наибольшей механической прочностью. Между тем, все остальные коллагены отличаются от него в одном или нескольких аспектах. Некоторые коллагены имеют разрывы в тройной спирали и не обязательно собираются в фибриллы.
| Тип коллагена | Гены | Молекулы | Органы | Ассоциированные болезни |
|---|---|---|---|---|
| I | COL1A1 COL1A2 | α1(I)2α2(I), α1(I)3 | Повсеместно в мягких и твёрдых тканях, в коже, костях, роговице глаза, в склере, в стенке артерий и др. | Синдром Элерса-Данлоса, остеогенез, ревматизм, синдром Марфана, дисплазии |
| II | COL2A1 | α1(II)3 + см тип XI | Гиалиновые и фиброзные хрящи, стекловидное тело, роговица | Коллагенопатия II и XI типа, синдром Стиклера, ахондрогенез |
| III | COL3A1 | α1(III)3 | Дерма кожи плода, стенки крупных кровеносных сосудов, ретикулярные волокна органов кроветворения | Синдром Элерса-Данлоса, фибромышечная дисплазия, аневризма аорты |
| IV | COL4A1 COL4A2 COL4A3 COL4A4 COL4A5 COL4A6 | α1(IV)2α2(IV), другие непонятно | Базальные мембраны, капсула хрусталика | Синдром Альпорта, синдроме Гудпасчера |
| V | COL5A1 COL5A2 COL5A3 | α1(V)2α2(V), α1(V)α2(V)α3(V) + см тип XI | Мягкие ткани, плацента, сосуды, хорион | Синдром Элерса-Данлоса |
| VI | COL6A1 COL6A2 COL6A3 COL6A4 COL6A5 COL6A6 | α1(VI)α2(VI)α3(VI) | Микрофибриллы в мягких тканях и хрящах | Миопатия Ульриха, миопатия Бэтлема, атопический дерматит |
| VII | COL7A1 | α1(VII)3 | Якорные фибриллы в связке кожи и эпидермиса | Буллезный эпидермолиз |
| VIII | COL8A1 COL8A2 | α1(VIII)α2(VIII) | Роговица, эндотелий | Дистрофия роговицы |
| IX | COL9A1 COL9A2 COL9A3 | α1(IX)α2(IX)α3(IX) | Хрящи, стекловидное тело | Синдром Стиклера, остеоартрит, эпифизарная дисплазия |
| X | COL10A1 | α1(X)3 | Гипертрофическая зона области роста | Метафизарная дисплазия Шмида |
| XI | COL11A1 COL11A2 | α1(XI)α2(XI)α1(II), α1(XI)α2(V)α1(II) | Хрящи, стекловидное тело | Коллагенопатия II и XI типов, остеопороз |
| XII | COL12A1 | α1(XII)3 | Мягкие ткани | Повреждения сухожилий |
| XIII | COL13A1 | α1(XIII)3 | Поверхность клеток, эпителиальные клетки | |
| XIV | COL14A1 | α1(IV)3 | Мягкие ткани | |
| XV | COL15A1 | α1(XV)3 | Эндотелиальные клетки | Карцинома |
| XVI | COL16A1 | α1(XVI)3 | Повсеместно | |
| XVII | COL17A1 | α1(XVII)3 | Поверхность эпидермальных клеток | Буллезный эпидермиолиз, пузырчатка |
| XVIII | COL18A1 | α1(XVIII)3 | Эндотелиальные клетки | |
| XIX | COL19A1 | α1(XIX)3 | Повсеместно | Меланома, карцинома |
| XX | COL20A1 | α1(XX)3 | Выделен из куриного эмбриона | |
| XXI | COL21A1 | α1(XXI)3 | Кровеносные сосуды | |
| XXII | COL22A1 | α1(XXII)3 | Только в местах мышечно-сухожильных соединений | |
| XXIII | COL23A1 | α1(XXIII)3 | Опухолевые клетки | |
| XXIV | COL24A1 | α1(XXIV)3 | Формирующиеся кости | Остеохондроз |
| XXV | COL25A1 | α1(XXV)3 | Атеросклеротические бляшки | Болезнь Альцгеймера |
| XXVI | COL26A1=EMID2 | α1(XXVI)3 | Половые органы | |
| XXVII | COL27A1 | α1(XXVII)3 | Мягкие ткани | |
| XXVIII | COL28A1 | α1(XXVIII)3 | Нервная система |
Медицинские аспекты
Нарушения синтеза коллагена в организме лежат в основе таких наследственных заболеваний, как дерматоспораксис у животных, латиризм (характерна разболтанность суставов, привычные вывихи), синдром Элерса-Данлоса (до 14 типов проявлений), несовершенный остеогенез (болезнь «стеклянного человека», врождённый рахит, врождённая ломкость костей), болезнь Марфана.
Характерным проявлением этих заболеваний является повреждение связочного аппарата, хрящей, костной системы, наличие пороков сердечных клапанов.
Болезни, вызванные дефектами при биосинтезе коллагена, в том числе так называемые коллагенозы, возникают из-за множества причин. Это может быть из-за мутации в гене, кодирующем аминокислотную последовательность ферментов, продуцирующих коллаген, приводящей к изменению формы коллагеновой молекулы, или ошибки в посттранстляционной модификации коллагена. Также болезни могут быть вызваны недостатком или «неправильной работой» ферментов, вовлеченных в биосинтез коллагена — дефицит ферментов гидроксилирования (пролин-, лизингидроксилазы), гликозилтрансфераз, N-проколлагеновой и С-проколлагеновой пептидаз, лизилоксидаз с последующим нарушением поперечных сшивок, дефицит меди, витаминов В6, В13 (оротовая кислота), C. При приобретённых болезнях, таких как цинга, восстановление баланса ферментов до нормального может привести к полному излечению.
Практически любая генная мутация ведёт к утрате или изменению функций коллагена, что, в свою очередь, отражается на свойствах тканей и органов. Генные мутации в коллагеновом домене могут привести к изменению формы тройной спирали путём вставки/выпадения аминокислоты из полипептидной цепочки или замены Gly на другое основание. Мутации в неколлагеновых доменах могут привести к неправильной пространственной сборке α-цепей в надмолекулярные структуры (фибриллы или сети), что также ведёт к утрате функций. Мутантные α-цепи способны образовывать трёхспиральный комплекс с нормальными α-цепями. В большинстве случаев, такие комплексы нестабильны и быстро разрушаются, однако, такая молекула может и нормально выполнять свою роль, если не затронуты функционально важные области. Большинство болезней, вызванных мутациями в «коллагеновых» генах, являются доминантными.
Примечания
Ссылки
Колаген — Вікіпедія
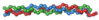 Потрійна спіраль тропоколагену.
Потрійна спіраль тропоколагену.Колаген — головний білок сполучної тканини тварин та білок, що має найбільший вміст у ссавців, до 25 % від повної маси білків організму. Слово «колаген» походить від грецького κόλλα [колла] — клей.
Вчені десятиліттями не могли зрозуміти молекулярну будову колагену. Перший доказ того, що колаген має постійну структуру на молекулярному рівні, було представлено в середині 30-х років минулого століття. З того часу багато видатних вчених, включаючи Нобелівських лауреатів, таких як, Френсіс Крік, Лайнус Полінг, Олександр Річ, Ада Йонат , Хелен Берман, Вілеайнур Рамачандран працювали над будовою мономеру колагену.
Кілька суперечливих одна одній моделей (незважаючи на відому структуру кожного пептидного ланцюга) дали дорогу для створення потрійно-спіральної моделі, яка пояснила четвертинну структуру молекули колагену.
Продуктом денатурації колагену є желатин. Температура денатурації макромолекули колагену близька до температури фібрилогенезу. Ця властивість молекули колагену робить її максимально чутливою до мутаційних замін.
Молекула колагену являє собою правозакручену спіраль з трьох α-ланцюгів. Таке утворення відоме під назвою тропоколагену[1]. Один виток спіралі α-ланцюга містить три амінокислотних залишки. Молекулярна маса колагену становить близько 300 кДа, довжина 300 нм, товщина 1,5 нм.
Для первинної структури білка характерний високий вміст гліцину, низький вміст сірковмісних амінокислот і відсутність триптофану. Колаген належить до тих небагатьох білків тваринного походження, які містять залишки нестандартних амінокислот: близько 21 % від загального числа залишків припадає на 3-гідроксипролін, 4-гідроксипролін та 5-гідроксилізин[2]. Кожен з α-ланцюгів складається з тріад амінокислот. У тріади третя амінокислота завжди гліцин, друга — пролін або лізин, перша — будь-яка інша амінокислота, крім трьох перерахованих[1].
Колаген існує в кількох формах. Основна структура всіх типів колагену є схожою. Колагенові волокна утворюються шляхом агрегації мікрофібрил, мають рожевий колір при забарвленні гематоксиліном і еозином і блакитний або зелений при різних трьоххромних забарвленнх, при імпрегнації сріблом фарбуються в буро-жовтий колір.
Фібрилярні структури[ред. | ред. код]
Тропоколагени (структурні одиниці колагену) спонтанно об’єднуються, прикріпляючись один до одного зміщеними на певну відстань кінцями, утворюючи в міжклітинній речовині більші структури. У фібрилярних колагенах молекули зміщені відносно одна одної приблизно на 67нм (одиниця, що позначається літерою «D» і змінюється в залежності від стану гідратації речовини). Загалом кожен D-період містить чотири цілих і одну п’яту молекули колагену. Величина 300 нм, поділена на 67 нм (300:67) не є цілим числом і довжина молекули колагену розділена на непостійні за величиною відрізки D. Отже, в розрізі кожного повтору D-періоду мікрофібрил є частина, що складається з п’яти молекул, названа «перекриття», і частина, що складається з чотирьох молекул — «розрив». Тропоколагени до того ж скомпоновані в шестикутну або псевдошестикутну (у поперечному розрізі) конструкцію, в кожній області «перекриття» і «розриву».
Всередині тропоколлагенів є ковалентні зв’язки між ланцюгами, а також деяке непостійна кількість даних зв’язків між самими тропоколагеновими спіралями, створюючими добре організовані структури (наприклад, фібрили). Товстіші пучки фібрил формуються за допомогою білків декількох інших класів, включаючи інші типи колагенів, глікопротеїни, протеоглікани, що використовуються для формування різних типів тканин з різних комбінацій одних і тих же основних білків. Нерозчинність колагену була перешкодою до вивчення мономеру колагену, до того моменту як було виявлено, що можливо отримати тропоколаген молодої тварини, оскільки він ще не утворив сильних зв’язків з іншими субодиниця фібрили. Тим не менше, вдосконалення мікроскопів і рентгенівських апаратів полегшили дослідження, з’являлося все більше докладних зображень структури молекули колагену. Ці пізні відкриття дуже важливі для кращого розуміння того, як структура колагену впливає на зв’язки між клітинами і міжклітинною речовиною, як тканини змінюються під час росту і регенерації, як вони змінюються під час ембріонального розвитку і при патології.
Колагенові фібрили — це напівкристалічна структурна одиниця колагену. Колагенові волокна — це пучки фібрил.
Застосовується для омолодження та догляду за шкірою обличчя, шиї і декольте, а також для догляду за шкірою інших делікатних ділянок тіла; при догляді за жирною проблемною шкірою, під час процедур після хімічних і лазерних пілінгів; в салонних програмах — як основа під маски; при не хірургічному ліфтингу обличчя, після хірургічної пластичної операції; для лікувального і тонізуючого масажу, після депіляції, після пілінгу; для зміцнення нігтів, нігтьового ложа, для розм’якшення загрубілої шкіри, мозолів, для відновлення і зміцнення волосяного покриву на голові і відновлення кольору волосся; для підтримки у відмінному стані здоров’я як БНВ (біологічно необхідна речовина), при опіках, для безрубцевого загоєння ран, при пародонтозі, як профілактичний засіб при артриті та ревматизмі.
Підвищення рівня колагену[ред. | ред. код]
Салонні процедури[ред. | ред. код]
Існує кілька салонних процедур, що стимулюють вироблення власного колагену.
- Іонофорез. Колаген у вигляді маски наноситься на шкіру, обличчя накривають плівкою, а зверху прикріплюють електроди. Під впливом струму подразнюються шкірні рецептори, колаген розпадається, через протоки сальних залоз потрапляє на певну глибину і накопичується в шкірі.
- Мезотерапія. Гель на основі колагену з допомогою ін’єкцій вводять вглиб шкіри, де він зберігається близько 9 місяців. Весь цей час клітини намагаються розчинити чужорідний матеріал, в процесі чого стимулюється вироблення власного колагену. Проте, на такі ін’єкції часто виникають алергічні реакції, тож перед процедурою необхідно виконати алергопроби.
- Рідоліз. У середній шар шкіри вводяться голчасті електроди, через які подається високочастотний струм. Він викликає пошкодження сполучної тканини і реактивний набряк. У відповідь організм починає виробляти нові колагенові волокна.[3]
Внутрішній прийом[ред. | ред. код]
Колаген входить до складу багатьох вітамінних комплексів і харчових добавок. Популярності набувають і страви з колагеном. У так званих ресторанах краси колагеновий порошок змішують з м’ясними та рибними стравами, подають пампушки з колагеновим наповнювачем і салат з колагену і морських водоростей. Людський організм погано засвоює цілісний білок колаген з їжі через великий розмір його молекул, близько 300 000 Да. Тому в спеціалізованому харчуванні: спортивному, дитячому, тощо, використовують білок колаген, який гідролізований до коротких пептидів амінокислот. В такій формі продукт засвоюється легко і майже повністю. Залежно від стану організму. Гідролізація білку колагену в даному випадку відбувається за допомогою ферментативного гідролізу.
Походження косметологічного колагену[ред. | ред. код]
- Тваринний. Його отримують зі шкіри великої рогатої худоби.
- Рослинний. Такого колагену не існує. Продукти, які пропонуються під такими назвами не мають жодного стосунку до колагену, а є вуглеводами.
- Морський або рибний. Видобувають з молюсків та риб.
У 2005 році американські вчені заявили, що їм вдалося виділити колаген зі збережених м’яких тканин тиранозавра[4] і використовувати його хімічний склад як ще один доказ спорідненості динозаврів із сучасними птахами[5]. Проте наступні наукові роботи поставили під сумнів ці заяви.[6] Тим не менш, в науковій літературі з’являються повідомлення про виявлення у скамянілостях структур, подібних до волокон колагену.[7]
Наукові дослідження в медицині[ред. | ред. код]
Синтез колагену — складний ферментативний багатостадійний процес, який повинен бути забезпечений достатньою кількістю вітамінів і мінеральних елементів. Синтез протікає в фібробласти і ряд стадій поза фібробласта. Важливий момент у синтезі — реакції гідроксилювання, які відкривають шлях подальшим модифікаціям, необхідним для дозрівання колагену. Каталізують реакції гідроксилювання специфічні ферменти. Так, утворення 4-оксипроліну каталізує пролінгідроксілаза, в активному центрі якої знаходиться залізо. Фермент активний у тому випадку, якщо залізо знаходиться в двовалентній формі, що забезпечується аскорбіновою кислотою (вітамін С). Дефіцит аскорбінової кислоти порушує процес гідроксилювання, що впливає на подальші стадії синтезу колагену — глікозилювання, відщеплення N-і С-кінцевих пептидів та ін. У результаті синтезується аномальний колаген, пухкіший. Ці зміни лежать в основі розвитку цинги.
- ↑ а б тропоколагену (Tropocollagen) в словнику dic.academic.ru
- ↑ XuMuK.ru — КОЛАГЕН — Хімічна енциклопедія
- ↑ — Коллаген: есть, колоть или мазать?
- ↑ Бі-бі-сі|Наука й техніка|Знайдено м’які тканини тиранозавра? — 25 березня 2005
- ↑ Елементи — новини науки: Колаген з кісток динозаврів — це вже реальність. — 20.04.07
- ↑ Stepanova, Anna; Kaye, Thomas G.; Gaugler, Gary; Sawlowicz, Zbigniew (2008). Dinosaurian Soft Tissues Interpreted as Bacterial Biofilms. PLoS ONE 3 (7): e2808. ISSN 1932-6203. doi:10.1371/journal.pone.0002808.
- ↑ Bertazzo, Sergio; Maidment, Susannah C. R.; Kallepitis, Charalambos; Fearn, Sarah; Stevens, Molly M.; Xie, Hai-nan (2015). Fibres and cellular structures preserved in 75-million–year-old dinosaur specimens. Nature Communications 6: 7352. ISSN 2041-1723. doi:10.1038/ncomms8352.
Коллаген — Википедия
Коллаге́н — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у животных; отсутствует у растений, бактерий, вирусов, простейших и грибов[1]. Коллаген — основной компонент соединительной ткани и самый распространённый белок у млекопитающих[2], составляющий от 25 % до 45% белков во всём теле.
История исследования
Учёные десятилетиями не могли понять молекулярное строение коллагена. Первое доказательство того, что коллаген имеет постоянное строение на молекулярном уровне, было представлено в середине 1930-х годов. С того времени много выдающихся учёных, включая Нобелевских лауреатов, таких как Фрэнсис Крик, Лайнус Полинг, Александр Рич, Ада Йонат, Хелен Берман, Вилеайнур Рамачандран, работали над строением мономера коллагена.
Несколько противоречащих друг другу моделей (несмотря на известное строение каждой отдельной пептидной цепи) дали дорогу для создания троично-спиральной модели, объяснившей четвертичное строение молекулы коллагена.
Свойства
Продуктом денатурации коллагена является желатин. Температура денатурации макромолекулы коллагена близка к температуре фибриллогенеза. Это свойство молекулы коллагена делает её максимально чувствительной к мутационным заменам.
Фибриллогенез — образование коллагеновых волокон в соединительной ткани путём сборки или объединения в пучки фибрилл — тонких белковых нитевидных структур внутри клетки и тканей человеческого организма. Фибриллогенез имеет важное значение в процессе приживления имплантанта и создания на его основе прочной, правильно функционирующей жевательной системы. Чем прочнее созданные в процессе фибриллогенеза коллагеновые волокна, тем прочнее соединительная ткань.
Структура
Молекула коллагена представляет собой левозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген[3]. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм.
Для первичной структуры белка характерно высокое содержание глицина, низкое содержание серосодержащих аминокислот и отсутствие триптофана. Коллаген относится к тем немногим белкам животного происхождения, которые содержат остатки нестандартных аминокислот: около 21 % от общего числа остатков приходится на 3-гидроксипролин, 4-гидроксипролин и 5-гидроксилизин[4]. Каждая из α-цепей состоит из триад аминокислот. В триадах третья аминокислота всегда глицин, вторая — пролин или лизин, первая — любая другая аминокислота, кроме трёх перечисленных[3].
Коллаген существует в нескольких формах. Основа строения всех видов коллагена является схожей. Коллагеновые волокна образуются путём агрегации микрофибрилл, имеют розовый цвет при окраске гематоксилином и эозином и голубой или зелёный при различных трёххромных окрасках, при импрегнации серебром окрашиваются в буро-жёлтый цвет.
Фибриллярная структура
Тропоколлагены (структурные единицы коллагена) спонтанно объединяются, прикрепляясь друг к другу смещёнными на определённое расстояние концами, образуя в межклеточном веществе более крупные структуры. В фибриллярных коллагенах молекулы смещены относительно друг друга примерно на 67 нм (единица, которая обозначается буквой «D» и меняется в зависимости от состояния гидратации вещества). В целом каждый D-период содержит четыре целых и часть пятой молекулы коллагена. Величина 300 нм, поделённая на 67 нм (300:67), не даёт целого числа, и длина молекулы коллагена разделена на непостоянные по величине отрезки D. Следовательно, в разрезе каждого повтора D-периода микрофибриллы есть часть, состоящая из пяти молекул, называемая «перекрытие», и часть, состоящая из четырёх молекул — «разрыв». Тропоколлагены к тому же скомпонованы в шестиугольную или псевдошестиугольную (в поперечном разрезе) конструкцию, в каждой области «перекрытия» и «разрыва».
Внутри тропоколлагенов существует ковалентная связь между цепями, а также некоторое непостоянное количество данных связей между самими тропоколагеновыми спиралями, образующими хорошо организованные структуры (например, фибриллы). Более толстые пучки фибрилл формируются с помощью белков нескольких других классов, включая другие типы коллагенов, гликопротеины, протеогликаны, использующихся для формирования различных типов тканей из разных комбинаций одних и тех же основных белков. Нерастворимость коллагена была препятствием к изучению мономера коллагена, до того момента как было обнаружено, что возможно извлечь тропоколлаген молодого животного, поскольку он ещё не образовал сильных связей с другими субъединицами фибриллы. Тем не менее, усовершенствование микроскопов и рентгеновских аппаратов облегчили исследования, появлялось всё больше подробных изображений структуры молекулы коллагена. Эти поздние открытия очень важны для лучшего понимания того, как структура коллагена влияет на связи между клетками и межклеточным веществом, как ткани меняются во время роста и регенерации, как они меняются во время эмбрионального развития и при патологии.
Коллагеновая фибрилла — это полукристаллическая структурная единица коллагена. Коллагеновые волокна — это пучки фибрилл.
Использование
Пищевая промышленность
С точки зрения питания, коллаген и желатин являются белками низкого качества, так как они не содержат всех незаменимых аминокислот, необходимых человеку — это неполноценные белки. Производители основанных на коллагене пищевых добавок утверждают, что их продукты могут улучшить качество кожи и ногтей, а также здоровье суставов[источник не указан 3380 дней].
Относительно дешёвые, часто предлагаемые сегодня на рынке под видом источника свободных аминокислот гидролизаты коллагена не всегда способны удовлетворить потребности человека в свободных аминокислотах, так как эти продукты не содержат готовые к усвоению аминокислоты, а являются лишь частично «переваренными» экстрактами суставных тканей млекопитающих, птиц или обитателей моря. Например, гидролизаты коллагена почти полностью лишены аминокислоты L-глютамина, не отличающейся стойкостью к термическому воздействию и долгому хранению сырья, большая часть глютамина разрушается уже на первых этапах хранения и переработки сырья, имеющийся небольшой остаток практически полностью распадается во время термической экстракции хрящевой ткани.
Наиболее качественными источниками аминокислот являются препараты, содержащие так называемые «свободные аминокислоты». Так как именно свободные аминокислоты являются практически готовыми к усвоению, организму не нужно тратить пищеварительные ферменты, время и энергию на их переваривание. Они способны в кратчайшие сроки поступить в кровь и, будучи доставленными ею к местам, нуждающимся в дополнительном синтезе коллагена, тут же включаются в его формирование[источник не указан 3116 дней].
Косметические средства
Коллаген входит в состав косметических средств для:
- Образования воздухопроницаемого, влагоудерживающего слоя на поверхности кожи, обладающего пластифицирующими (разглаживающими) свойствами, со свойствами влажного компресса;
- Продления действия экстрактов, масел и др. в составе косметических композиций;
- Придания блеска волосам, создания коллагенового (защитного) слоя на поверхности волос.
Научные исследования
В 2005 году учёным удалось выделить коллаген из сохранившихся мягких тканей тираннозавра[5][нет в источнике] и использовать его химический состав как ещё одно доказательство родства динозавров с современными птицами[6].
Научные исследования в медицине
Синтез коллагена — сложный ферментативный многостадийный процесс, который должен быть обеспечен достаточным количеством витаминов и минеральных элементов. Синтез протекает в фибробласте и ряд стадий вне фибробласта. Важный момент в синтезе — реакции гидроксилирования, которые открывают путь дальнейшим модификациям, необходимым для созревания коллагена. Катализируют реакции гидроксилирования специфические ферменты. Так, образование 4-оксипролина катализирует пролингидроксилаза, в активном центре которой находится железо. Фермент активен в том случае, если железо находится в двухвалентной форме, что обеспечивается аскорбиновой кислотой (витамин C). Дефицит аскорбиновой кислоты нарушает процесс гидроксилирования, что влияет на дальнейшие стадии синтеза коллагена: гликозилирование, отщепление N- и С-концевых пептидов и др. В результате синтезируется аномальный коллаген, более рыхлый. Эти изменения лежат в основе развития цинги. Коллаген и эластин формируют своеобразную «основу» кожи, которая предотвращает её обвисание, обеспечивает её эластичность и упругость. Эластин как белок прекращает выработку ферментов в человеческом организме в 14 лет, а коллаген — в 21—25, после чего кожные покровы не восстанавливаются и кожа стареет. Также важнейшим компонентом соединительной ткани является кератин — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога, перья и др.
Фотография
Белок является основой для фотографической желатины, которая вместе с микрокристаллами галогенидов серебра образует фотографическую эмульсию. При получении фотографической желатины коллаген денатурируют кислотой или щёлочью. Фотографическая эмульсия, нанесённая тонким слоем на целлулоидную плёнку, стекло или бумагу, а затем высушенная, — это и есть светочувствительный слой фотоматериала (например, фотоплёнки).
Типы коллагена
В настоящее время описано 28 типов коллагена, которые кодируются более чем 40 генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации — интенсивности гидроксилирования или гликозилирования. Общим для всех коллагенов является существование 1 или более доменов, содержащих тройную спираль и присутствие их во внеклеточном матриксе. Более 90 % всего коллагена высших организмов приходится на коллагены I, II,III и IV типов.
| Разновидности коллагена | Типы |
|---|---|
| Фибриллярные коллагены | I, II, III, V, XI, XXIV, XXVII |
| Фибрилл-ассоциированные коллагены (FACIT) | IX, XII, XIV, XVI, XIX, XX, XXI, XXII |
| Коллагены, формирующие филаменты- бусины (beaded filament forming) | VI |
| Сетеобразующие коллагены | IV, VIII, X |
| Коллаген, формирующий якорные фибриллы | VII |
| Трансмембранные коллагены | XIII, XVII, XXIII, XXV/CLAC-P |
| Другие коллагены | XXVIII, XV, XVIII |
Кроме коллагеновых белков существует множество других белков, содержащих в своей структуре домен с тройной коллагеновой спиралью[7][8]. И, тем не менее, их не причисляют к коллагенам, а только к «коллагеноподобным». К большой группе коллагеноподобных белков относятся подкомпонент C1q-комплемента, C1q-подобный фактор, адипонектин, колектины и фиколины, концевая структура ацетилхолинестаразы, три макрофаговых рецептора, эктодисплазин и EMILIN. Эти белки, так же как и коллагены, играют структурную и регуляторную роль.
Коллаген первого типа, самый архетипичный, является тримерным белком, собирающимся в тройные спирали без разрывов, самособирающимся в фибриллы и обладающим наибольшей механической прочностью. Между тем, все остальные коллагены отличаются от него в одном или нескольких аспектах. Некоторые коллагены имеют разрывы в тройной спирали и не обязательно собираются в фибриллы.
| Тип коллагена | Гены | Молекулы | Органы | Ассоциированные болезни |
|---|---|---|---|---|
| I | COL1A1 COL1A2 | α1(I)2α2(I), α1(I)3 | Повсеместно в мягких и твёрдых тканях, в коже, костях, роговице глаза, в склере, в стенке артерий и др. | Синдром Элерса-Данлоса, остеогенез, ревматизм, синдром Марфана, дисплазии |
| II | COL2A1 | α1(II)3 + см тип XI | Гиалиновые и фиброзные хрящи, стекловидное тело, роговица | Коллагенопатия II и XI типа, синдром Стиклера, ахондрогенез |
| III | COL3A1 | α1(III)3 | Дерма кожи плода, стенки крупных кровеносных сосудов, ретикулярные волокна органов кроветворения | Синдром Элерса-Данлоса, фибромышечная дисплазия, аневризма аорты |
| IV | COL4A1 COL4A2 COL4A3 COL4A4 COL4A5 COL4A6 | α1(IV)2α2(IV), другие непонятно | Базальные мембраны, капсула хрусталика | Синдром Альпорта, синдроме Гудпасчера |
| V | COL5A1 COL5A2 COL5A3 | α1(V)2α2(V), α1(V)α2(V)α3(V) + см тип XI | Мягкие ткани, плацента, сосуды, хорион | Синдром Элерса-Данлоса |
| VI | COL6A1 COL6A2 COL6A3 COL6A4 COL6A5 COL6A6 | α1(VI)α2(VI)α3(VI) | Микрофибриллы в мягких тканях и хрящах | Миопатия Ульриха, миопатия Бэтлема, атопический дерматит |
| VII | COL7A1 | α1(VII)3 | Якорные фибриллы в связке кожи и эпидермиса | Буллезный эпидермолиз |
| VIII | COL8A1 COL8A2 | α1(VIII)α2(VIII) | Роговица, эндотелий | Дистрофия роговицы |
| IX | COL9A1 COL9A2 COL9A3 | α1(IX)α2(IX)α3(IX) | Хрящи, стекловидное тело | Синдром Стиклера, остеоартрит, эпифизарная дисплазия |
| X | COL10A1 | α1(X)3 | Гипертрофическая зона области роста | Метафизарная дисплазия Шмида |
| XI | COL11A1 COL11A2 | α1(XI)α2(XI)α1(II), α1(XI)α2(V)α1(II) | Хрящи, стекловидное тело | Коллагенопатия II и XI типов, остеопороз |
| XII | COL12A1 | α1(XII)3 | Мягкие ткани | Повреждения сухожилий |
| XIII | COL13A1 | α1(XIII)3 | Поверхность клеток, эпителиальные клетки | |
| XIV | COL14A1 | α1(IV)3 | Мягкие ткани | |
| XV | COL15A1 | α1(XV)3 | Эндотелиальные клетки | Карцинома |
| XVI | COL16A1 | α1(XVI)3 | Повсеместно | |
| XVII | COL17A1 | α1(XVII)3 | Поверхность эпидермальных клеток | Буллезный эпидермиолиз, пузырчатка |
| XVIII | COL18A1 | α1(XVIII)3 | Эндотелиальные клетки | |
| XIX | COL19A1 | α1(XIX)3 | Повсеместно | Меланома, карцинома |
| XX | COL20A1 | α1(XX)3 | Выделен из куриного эмбриона | |
| XXI | COL21A1 | α1(XXI)3 | Кровеносные сосуды | |
| XXII | COL22A1 | α1(XXII)3 | Только в местах мышечно-сухожильных соединений | |
| XXIII | COL23A1 | α1(XXIII)3 | Опухолевые клетки | |
| XXIV | COL24A1 | α1(XXIV)3 | Формирующиеся кости | Остеохондроз |
| XXV | COL25A1 | α1(XXV)3 | Атеросклеротические бляшки | Болезнь Альцгеймера |
| XXVI | COL26A1=EMID2 | α1(XXVI)3 | Половые органы | |
| XXVII | COL27A1 | α1(XXVII)3 | Мягкие ткани | |
| XXVIII | COL28A1 | α1(XXVIII)3 | Нервная система |
Медицинские аспекты
Нарушения синтеза коллагена в организме лежат в основе таких наследственных заболеваний, как дерматоспораксис у животных, латиризм (характерна разболтанность суставов, привычные вывихи), синдром Элерса-Данлоса (до 14 типов проявлений), несовершенный остеогенез (болезнь «стеклянного человека», врождённый рахит, врождённая ломкость костей), болезнь Марфана, муковисцидоз.
Характерным проявлением этих заболеваний является повреждение связочного аппарата, хрящей, костной системы, наличие пороков сердечных клапанов.
Болезни, вызванные дефектами при биосинтезе коллагена, в том числе так называемые коллагенозы, возникают из-за множества причин. Это может быть из-за мутации в гене, кодирующем аминокислотную последовательность ферментов, продуцирующих коллаген, приводящей к изменению формы коллагеновой молекулы, или ошибки в посттранстляционной модификации коллагена. Также болезни могут быть вызваны недостатком или «неправильной работой» ферментов, вовлечённых в биосинтез коллагена — дефицит ферментов гидроксилирования (пролин-, лизингидроксилазы), гликозилтрансфераз, N-проколлагеновой и С-проколлагеновой пептидаз, лизилоксидаз с последующим нарушением поперечных сшивок, дефицит меди, витаминов B6, B13 (оротовая кислота), C. При приобретённых болезнях, таких как цинга, восстановление баланса ферментов до нормального может привести к полному излечению.
Практически любая генная мутация ведёт к утрате или изменению функций коллагена, что, в свою очередь, отражается на свойствах тканей и органов. Генные мутации в коллагеновом домене могут привести к изменению формы тройной спирали путём вставки/выпадения аминокислоты из полипептидной цепочки или замены Gly на другое основание. Мутации в неколлагеновых доменах могут привести к неправильной пространственной сборке α-цепей в надмолекулярные структуры (фибриллы или сети), что также ведёт к утрате функций. Мутантные α-цепи способны образовывать трёхспиральный комплекс с нормальными α-цепями. В большинстве случаев, такие комплексы нестабильны и быстро разрушаются, однако, такая молекула может и нормально выполнять свою роль, если не затронуты функционально важные области. Большинство болезней, вызванных мутациями в «коллагеновых» генах, являются доминантными.
Примечания
- ↑ Fibrillar collagen: the key to vertebrate evolution? A tale of molecular incest. Boot-Handford RP, Tuckwell DS. Bioessays. 2003 Feb;25(2):142-51.
- ↑ Di Lullo, Gloria A.; Sweeney, Shawn M.; Körkkö, Jarmo; Ala-Kokko, Leena; San Antonio, James D. Mapping the Ligand-binding Sites and Disease-associated Mutations on the Most Abundant Protein in the Human, Type I Collagen (англ.) // Journal of Biological Chemistry|J. Biol. Chem. : journal. — 2002. — Vol. 277, no. 6. — P. 4223—4231. — DOI:10.1074/jbc.M110709200. — PMID 11704682.
- ↑ 1 2 Тропоколлаген (Tropocollagen) в словаре dic.academic.ru
- ↑ XuMuK.ru — КОЛЛАГЕН — Химическая энциклопедия
- ↑ Би-би-си | Наука и техника | Найдены мягкие ткани тираннозавра? — 25 марта 2005 г.
- ↑ Элементы — новости науки: Коллаген из костей динозавров — это уже реальность. — 20.04.07
- ↑ Franzke CW, Bruckner P, Bruckner-Tuderman L. Collagenous transmembrane proteins: recent insights into biology and pathology. J Biol Chem. 2005 Feb 11;280(6):4005-8.
- ↑ Hoppe HJ, Reid KB. Collectins—soluble proteins containing collagenous regions and lectin domains—and their roles in innate immunity. Protein Sci. 1994 Aug;3(8):1143-58
Литература
Коллаген — Википедия

Коллаген — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у многоклеточных животных; отсутствует у растений, бактерий, вирусов, простейших и грибов[1]. Коллаген — основной компонент соединительной ткани и самый распространённый белок у млекопитающих[2], составляющий от 25 % до 45% белков во всём теле.
История исследования
Учёные десятилетиями не могли понять молекулярное строение коллагена. Первое доказательство того, что коллаген имеет постоянное строение на молекулярном уровне, было представлено в середине 1930-х годов. С того времени много выдающихся учёных, включая Нобелевских лауреатов, таких как Фрэнсис Крик, Лайнус Полинг, Александр Рич, Ада Йонат, Хелен Берман, Вилеайнур Рамачандран, работали над строением мономера коллагена.
Несколько противоречащих друг другу моделей (несмотря на известное строение каждой отдельной пептидной цепи) дали дорогу для создания троично-спиральной модели, объяснившей четвертичное строение молекулы коллагена.
Свойства
Продуктом денатурации коллагена является желатин. Температура денатурации макромолекулы коллагена близка к температуре фибриллогенеза. Это свойство молекулы коллагена делает её максимально чувствительной к мутационным заменам.
Структура

Молекула коллагена представляет собой левозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген[3]. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм.
Для первичной структуры белка характерно высокое содержание глицина, низкое содержание серосодержащих аминокислот и отсутствие триптофана. Коллаген относится к тем немногим белкам животного происхождения, которые содержат остатки нестандартных аминокислот: около 21 % от общего числа остатков приходится на 3-гидроксипролин, 4-гидроксипролин и 5-гидроксилизин[4]. Каждая из α-цепей состоит из триад аминокислот. В триадах третья аминокислота всегда глицин, вторая — пролин или лизин, первая — любая другая аминокислота, кроме трёх перечисленных[3].
Коллаген существует в нескольких формах. Основа строения всех видов коллагена является схожей. Коллагеновые волокна образуются путём агрегации микрофибрилл, имеют розовый цвет при окраске гематоксилином и эозином и голубой или зелёный при различных трёххромных окрасках, при импрегнации серебром окрашиваются в буро-жёлтый цвет.
Фибриллярная структура
Тропоколлагены (структурные единицы коллагена) спонтанно объединяются, прикрепляясь друг к другу смещенными на определённое расстояние концами, образуя в межклеточном веществе более крупные структуры. В фибриллярных коллагенах молекулы смещены относительно друг друга примерно на 67нм (единица, которая обозначается буквой «D» и меняется в зависимости от состояния гидратации вещества). В целом каждый D-период содержит четыре целых и часть пятой молекулы коллагена. Величина 300 нм, поделенная на 67 нм (300:67) не дают целого числа и длина молекулы коллагена разделена на непостоянные по величине отрезки D. Следовательно, в разрезе каждого повтора D-периода микрофибриллы есть часть, состоящая из пяти молекул, называемая «перекрытие», и часть, состоящая из четырёх молекул — «разрыв». Тропоколлагены к тому же скомпонованы в шестиугольную или псевдошестиугольную (в поперечном разрезе) конструкцию, в каждой области «перекрытия» и «разрыва».
Внутри тропоколлагенов существует ковалентная связь между цепями, а также некоторое непостоянное количество данных связей между самими тропоколагеновыми спиралями, образующими хорошо организованные структуры (например, фибриллы). Более толстые пучки фибрилл формируются с помощью белков нескольких других классов, включая другие типы коллагенов, гликопротеины, протеогликаны, использующихся для формирования различных типов тканей из разных комбинаций одних и тех же основных белков. Нерастворимость коллагена была препятствием к изучению мономера коллагена, до того момента как было обнаружено, что возможно извлечь тропоколлаген молодого животного, поскольку он ещё не образовал сильных связей с другими субъединицами фибриллы. Тем не менее, усовершенствование микроскопов и рентгеновских аппаратов облегчили исследования, появлялось все больше подробных изображений структуры молекулы коллагена. Эти поздние открытия очень важны для лучшего понимания того, как структура коллагена влияет на связи между клетками и межклеточным веществом, как ткани меняются во время роста и регенерации, как они меняются во время эмбрионального развития и при патологии.
Коллагеновая фибрилла — это полукристаллическая структурная единица коллагена. Коллагеновые волокна — это пучки фибрилл.
Использование
Пищевая промышленность
С точки зрения питания, коллаген и желатин являются белками низкого качества, так как они не содержат всех незаменимых аминокислот, необходимых человеку — это неполноценные белки. Производители основанных на коллагене пищевых добавок утверждают, что их продукты могут улучшить качество кожи и ногтей, а также здоровье суставов[источник не указан 3056 дней].
Относительно дешёвые, часто предлагаемые сегодня на рынке под видом источника свободных аминокислот гидролизаты коллагена не всегда способны удовлетворить потребности человека в свободных аминокислотах, так как эти продукты не содержат готовые к усвоению аминокислоты, а являются лишь частично «переваренными» экстрактами суставных тканей млекопитающих, птиц или обитателей моря. Например, гидролизаты коллагена почти полностью лишены аминокислоты L-глютамина, не отличающейся стойкостью к термическому воздействию и долгому хранению сырья, большая часть глютамина разрушается уже на первых этапах хранения и переработки сырья, имеющийся небольшой остаток практически полностью распадается во время термической экстракции хрящевой ткани.
Наиболее качественными источниками аминокислот являются препараты, содержащие так называемые «свободные аминокислоты». Так как именно свободные аминокислоты являются практически готовыми к усвоению, организму не нужно тратить пищеварительные ферменты, время и энергию на их переваривание. Они способны в кратчайшие сроки поступить в кровь и, будучи доставленными ею к местам, нуждающимся в дополнительном синтезе коллагена, тут же включаются в его формирование[источник не указан 2792 дня].
Косметические средства
Коллаген входит в состав косметических средств для :
- Образования воздухопроницаемого, влагоудерживающего слоя на поверхности кожи, обладающего пластифицирующими (разглаживающими) свойствами, со свойствами влажного компресса;
- Продления действия экстрактов, масел и др. в составе косметических композиций;
- Придания блеска волосам, создания коллагенового (защитного) слоя на поверхности волос.
Научные исследования
В 2005 году учёным удалось выделить коллаген из сохранившихся мягких тканей тираннозавра[5][нет в источнике] и использовать его химический состав как ещё одно доказательство родства динозавров с современными птицами[6].
Научные исследования в медицине
Синтез коллагена — сложный ферментативный многостадийный процесс, который должен быть обеспечен достаточным количеством витаминов и минеральных элементов. Синтез протекает в фибробласте и ряд стадий вне фибробласта. Важный момент в синтезе — реакции гидроксилирования, которые открывают путь дальнейшим модификациям, необходимым для созревания коллагена. Катализируют реакции гидроксилирования специфические ферменты. Так, образование 4-оксипролина катализирует пролингидроксилаза, в активном центре которой находится железо. Фермент активен в том случае, если железо находится в двухвалентной форме, что обеспечивается аскорбиновой кислотой (витамин С). Дефицит аскорбиновой кислоты нарушает процесс гидроксилирования, что влияет на дальнейшие стадии синтеза коллагена: гликозилирование, отщепление N- и С-концевых пептидов и др. В результате синтезируется аномальный коллаген, более рыхлый. Эти изменения лежат в основе развития цинги. Коллаген и эластин формируют своеобразную «основу» кожи, которая предотвращает её обвисание, обеспечивает её эластичность и упругость. Эластин как белок прекращает выработку ферментов в человеческом организме в 14 лет, а коллаген — в 21—25, после чего кожные покровы не восстанавливаются и кожа стареет. Также важнейшим компонентом соединительной ткани является кератин — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога, перья и др.
Фотография
Белок является основой для фотографической желатины, которая вместе с микрокристаллами галогенидов серебра образует фотографическую эмульсию. При получении фотографической желатины коллаген денатурируют кислотой или щёлочью. Фотографическая эмульсия, нанесённая тонким слоем на целлулоидную плёнку, стекло или бумагу, а затем высушенная, — это и есть светочувствительный слой фотоматериала (например, фотоплёнки).
Типы коллагена
В настоящее время описано 28 типов коллагена, которые кодируются более чем 40 генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации — интенсивности гидроксилирования или гликозилирования. Общим для всех коллагенов является существование 1 или более доменов, содержащих тройную спираль и присутствие их во внеклеточном матриксе. Более 90 % всего коллагена высших организмов приходится на коллагены I, II,III и IV типов.
| Разновидности коллагена | Типы |
|---|---|
| Фибриллярные коллагены | I, II, III, V, XI, XXIV, XXVII |
| Фибрилл-ассоциированные коллагены (FACIT) | IX, XII, XIV, XVI, XIX, XX, XXI, XXII |
| Коллагены, формирующие филаменты- бусины (beaded filament forming) | VI |
| Сетеобразующие коллагены | IV, VIII, X |
| Коллаген, формирующий якорные фибриллы | VII |
| Трансмембранные коллагены | XIII, XVII, XXIII, XXV/CLAC-P |
| Другие коллагены | XXVIII, XV, XVIII |
Кроме коллагеновых белков существует множество других белков, содержащих в своей структуре домен с тройной коллагеновой спиралью[7][8]. И, тем не менее, их не причисляют к коллагенам, а только к «коллагеноподобным». К большой группе коллагеноподобных белков относятся подкомпонент C1q-комплемента, C1q-подобный фактор, адипонектин, колектины и фиколины, концевая структура ацетилхолинестаразы, три макрофаговых рецептора, эктодисплазин и EMILIN. Эти белки, так же как и коллагены, играют структурную и регуляторную роль.
Коллаген первого типа, самый архетипичный, является тримерным белком, собирающимся в тройные спирали без разрывов, самособирающимся в фибриллы и обладающим наибольшей механической прочностью. Между тем, все остальные коллагены отличаются от него в одном или нескольких аспектах. Некоторые коллагены имеют разрывы в тройной спирали и не обязательно собираются в фибриллы.
| Тип коллагена | Гены | Молекулы | Органы | Ассоциированные болезни |
|---|---|---|---|---|
| I | COL1A1 COL1A2 | α1(I)2α2(I), α1(I)3 | Повсеместно в мягких и твёрдых тканях, в коже, костях, роговице глаза, в склере, в стенке артерий и др. | Синдром Элерса-Данлоса, остеогенез, ревматизм, синдром Марфана, дисплазии |
| II | COL2A1 | α1(II)3 + см тип XI | Гиалиновые и фиброзные хрящи, стекловидное тело, роговица | Коллагенопатия II и XI типа, синдром Стиклера, ахондрогенез |
| III | COL3A1 | α1(III)3 | Дерма кожи плода, стенки крупных кровеносных сосудов, ретикулярные волокна органов кроветворения | Синдром Элерса-Данлоса, фибромышечная дисплазия, аневризма аорты |
| IV | COL4A1 COL4A2 COL4A3 COL4A4 COL4A5 COL4A6 | α1(IV)2α2(IV), другие непонятно | Базальные мембраны, капсула хрусталика | Синдром Альпорта, синдроме Гудпасчера |
| V | COL5A1 COL5A2 COL5A3 | α1(V)2α2(V), α1(V)α2(V)α3(V) + см тип XI | Мягкие ткани, плацента, сосуды, хорион | Синдром Элерса-Данлоса |
| VI | COL6A1 COL6A2 COL6A3 COL6A4 COL6A5 COL6A6 | α1(VI)α2(VI)α3(VI) | Микрофибриллы в мягких тканях и хрящах | Миопатия Ульриха, миопатия Бэтлема, атопический дерматит |
| VII | COL7A1 | α1(VII)3 | Якорные фибриллы в связке кожи и эпидермиса | Буллезный эпидермолиз |
| VIII | COL8A1 COL8A2 | α1(VIII)α2(VIII) | Роговица, эндотелий | Дистрофия роговицы |
| IX | COL9A1 COL9A2 COL9A3 | α1(IX)α2(IX)α3(IX) | Хрящи, стекловидное тело | Синдром Стиклера, остеоартрит, эпифизарная дисплазия |
| X | COL10A1 | α1(X)3 | Гипертрофическая зона области роста | Метафизарная дисплазия Шмида |
| XI | COL11A1 COL11A2 | α1(XI)α2(XI)α1(II), α1(XI)α2(V)α1(II) | Хрящи, стекловидное тело | Коллагенопатия II и XI типов, остеопороз |
| XII | COL12A1 | α1(XII)3 | Мягкие ткани | Повреждения сухожилий |
| XIII | COL13A1 | α1(XIII)3 | Поверхность клеток, эпителиальные клетки | |
| XIV | COL14A1 | α1(IV)3 | Мягкие ткани | |
| XV | COL15A1 | α1(XV)3 | Эндотелиальные клетки | Карцинома |
| XVI | COL16A1 | α1(XVI)3 | Повсеместно | |
| XVII | COL17A1 | α1(XVII)3 | Поверхность эпидермальных клеток | Буллезный эпидермиолиз, пузырчатка |
| XVIII | COL18A1 | α1(XVIII)3 | Эндотелиальные клетки | |
| XIX | COL19A1 | α1(XIX)3 | Повсеместно | Меланома, карцинома |
| XX | COL20A1 | α1(XX)3 | Выделен из куриного эмбриона | |
| XXI | COL21A1 | α1(XXI)3 | Кровеносные сосуды | |
| XXII | COL22A1 | α1(XXII)3 | Только в местах мышечно-сухожильных соединений | |
| XXIII | COL23A1 | α1(XXIII)3 | Опухолевые клетки | |
| XXIV | COL24A1 | α1(XXIV)3 | Формирующиеся кости | Остеохондроз |
| XXV | COL25A1 | α1(XXV)3 | Атеросклеротические бляшки | Болезнь Альцгеймера |
| XXVI | COL26A1=EMID2 | α1(XXVI)3 | Половые органы | |
| XXVII | COL27A1 | α1(XXVII)3 | Мягкие ткани | |
| XXVIII | COL28A1 | α1(XXVIII)3 | Нервная система |
Медицинские аспекты
Нарушения синтеза коллагена в организме лежат в основе таких наследственных заболеваний, как дерматоспораксис у животных, латиризм (характерна разболтанность суставов, привычные вывихи), синдром Элерса-Данлоса (до 14 типов проявлений), несовершенный остеогенез (болезнь «стеклянного человека», врождённый рахит, врождённая ломкость костей), болезнь Марфана.
Характерным проявлением этих заболеваний является повреждение связочного аппарата, хрящей, костной системы, наличие пороков сердечных клапанов.
Болезни, вызванные дефектами при биосинтезе коллагена, в том числе так называемые коллагенозы, возникают из-за множества причин. Это может быть из-за мутации в гене, кодирующем аминокислотную последовательность ферментов, продуцирующих коллаген, приводящей к изменению формы коллагеновой молекулы, или ошибки в посттранстляционной модификации коллагена. Также болезни могут быть вызваны недостатком или «неправильной работой» ферментов, вовлеченных в биосинтез коллагена — дефицит ферментов гидроксилирования (пролин-, лизингидроксилазы), гликозилтрансфераз, N-проколлагеновой и С-проколлагеновой пептидаз, лизилоксидаз с последующим нарушением поперечных сшивок, дефицит меди, витаминов В6, В13 (оротовая кислота), C. При приобретённых болезнях, таких как цинга, восстановление баланса ферментов до нормального может привести к полному излечению.
Практически любая генная мутация ведёт к утрате или изменению функций коллагена, что, в свою очередь, отражается на свойствах тканей и органов. Генные мутации в коллагеновом домене могут привести к изменению формы тройной спирали путём вставки/выпадения аминокислоты из полипептидной цепочки или замены Gly на другое основание. Мутации в неколлагеновых доменах могут привести к неправильной пространственной сборке α-цепей в надмолекулярные структуры (фибриллы или сети), что также ведёт к утрате функций. Мутантные α-цепи способны образовывать трёхспиральный комплекс с нормальными α-цепями. В большинстве случаев, такие комплексы нестабильны и быстро разрушаются, однако, такая молекула может и нормально выполнять свою роль, если не затронуты функционально важные области. Большинство болезней, вызванных мутациями в «коллагеновых» генах, являются доминантными.
Примечания
Ссылки
Коллаген — Уикипедия
Уикипедия — ашық энциклопедиясынан алынған мәлімет
Коллаген (грек. kolla – желім және ген) – склеропротеидтер тобына жататын фибриллалы белок, жануарлардың дәнекер ұлпасының коллаген талшықтарының бір бөлігі. Коллагеннің молекуласы (ұзындығы 0,3 мкм , қалыңд. 0,015 мкм ) спираль тәрізді үш полипептидтік тізбектен тұрады. Толық жетілген талшықтардың Коллагені су мен органикалық еріткіштерде ерімейді, оны ерітуге 10%-ке дейінгі сілті ерітіндісі қолданылады. Толық жетілмеген талшықтардың Коллагенін (проколлаген немесе тропоколлаген) әлсіз қышқылда ерітуге болады. Коллаген жануарларда барлық ақуыздың үш бөлігіндей болғандықтан, ол дәнекер ұлпасының тарамыс, сіңір, шеміршек, тері, сүйек, балық қабыршағының маңызды құрамдас бөлігі, негізгі тірегі. Адам мен жануарлардың дәнекер тінінің (ұлпасының) талшығын коллаген талшықтары деп атайды. Оның негізі коллаген ақуызынан тұрады. Коллаген талшығының жуанд. 1 – 12 мкм, ал диам. 0,3 – 0,5 мкм, тармақталған фибрилла жіпшелерінен тұрады. Ал фибриллалар жуанд. 0,04 мкм микрофибриллалардан құралады. Коллаген талшығында проколлаген не тропоколлаген молекуласы микрофибриллалардың ұзына бойына қара, ашық түсті болып кезектесіп орналасады. Коллаген талшықтарының серпімділігі нашар, олар шеміршекте болса – хондриондық, сүйектен табылса – оссейндік талшықтар деп аталады. Коллаген типті ақуыздар сүтқоректілердің терісінен (ретикулин), көздің шыны тәрізді денесінен (витрозин), сүйекті және шеміршекті балықтардың, маржандардың, губкалардың тінінен (спонгин, горгонин, антипатин) алынған. Өсімдіктерде Коллаген кездеспейді. Илік заттар Коллагеннің химиялық және физикалық, сондай-ақ, бактериялық әсерлерге беріктігін арттырады, тері илеу осы қасиетке негізделген. Көптеген бактерия уларының қауіпті әрекеті, организмдегі тіршілік үшін маңызы зор қосылыстардың бүлінуі коллагеноза ферментінің әрекетіне байланысты. Дәнекер ұлпаның (Коллаген талшықтарының) морфолгиялық белгілерінің өзгеруіне байланысты пайда болатын сырқаттарды коллагеноздар деп атайды (қараңыз [1]).
Дереккөздер[өңдеу]
- ↑ Коллагендік аурулар
Қазақ Энциклопедиясы, 11 — том
Коллаген — Википедия

Коллаге́н — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у животных; отсутствует у растений, бактерий, вирусов, простейших и грибов[1]. Коллаген — основной компонент соединительной ткани и самый распространённый белок у млекопитающих[2], составляющий от 25 % до 45% белков во всём теле.
История исследования
Учёные десятилетиями не могли понять молекулярное строение коллагена. Первое доказательство того, что коллаген имеет постоянное строение на молекулярном уровне, было представлено в середине 1930-х годов. С того времени много выдающихся учёных, включая Нобелевских лауреатов, таких как Фрэнсис Крик, Лайнус Полинг, Александр Рич, Ада Йонат, Хелен Берман, Вилеайнур Рамачандран, работали над строением мономера коллагена.
Несколько противоречащих друг другу моделей (несмотря на известное строение каждой отдельной пептидной цепи) дали дорогу для создания троично-спиральной модели, объяснившей четвертичное строение молекулы коллагена.
Свойства
Продуктом денатурации коллагена является желатин. Температура денатурации макромолекулы коллагена близка к температуре фибриллогенеза. Это свойство молекулы коллагена делает её максимально чувствительной к мутационным заменам.
Фибриллогенез — образование коллагеновых волокон в соединительной ткани путём сборки или объединения в пучки фибрилл — тонких белковых нитевидных структур внутри клетки и тканей человеческого организма. Фибриллогенез имеет важное значение в процессе приживления имплантанта и создания на его основе прочной, правильно функционирующей жевательной системы. Чем прочнее созданные в процессе фибриллогенеза коллагеновые волокна, тем прочнее соединительная ткань.
Структура

Молекула коллагена представляет собой левозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген[3]. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм.
Для первичной структуры белка характерно высокое содержание глицина, низкое содержание серосодержащих аминокислот и отсутствие триптофана. Коллаген относится к тем немногим белкам животного происхождения, которые содержат остатки нестандартных аминокислот: около 21 % от общего числа остатков приходится на 3-гидроксипролин, 4-гидроксипролин и 5-гидроксилизин[4]. Каждая из α-цепей состоит из триад аминокислот. В триадах третья аминокислота всегда глицин, вторая — пролин или лизин, первая — любая другая аминокислота, кроме трёх перечисленных[3].
Коллаген существует в нескольких формах. Основа строения всех видов коллагена является схожей. Коллагеновые волокна образуются путём агрегации микрофибрилл, имеют розовый цвет при окраске гематоксилином и эозином и голубой или зелёный при различных трёххромных окрасках, при импрегнации серебром окрашиваются в буро-жёлтый цвет.
Фибриллярная структура
Тропоколлагены (структурные единицы коллагена) спонтанно объединяются, прикрепляясь друг к другу смещёнными на определённое расстояние концами, образуя в межклеточном веществе более крупные структуры. В фибриллярных коллагенах молекулы смещены относительно друг друга примерно на 67 нм (единица, которая обозначается буквой «D» и меняется в зависимости от состояния гидратации вещества). В целом каждый D-период содержит четыре целых и часть пятой молекулы коллагена. Величина 300 нм, поделённая на 67 нм (300:67), не даёт целого числа, и длина молекулы коллагена разделена на непостоянные по величине отрезки D. Следовательно, в разрезе каждого повтора D-периода микрофибриллы есть часть, состоящая из пяти молекул, называемая «перекрытие», и часть, состоящая из четырёх молекул — «разрыв». Тропоколлагены к тому же скомпонованы в шестиугольную или псевдошестиугольную (в поперечном разрезе) конструкцию, в каждой области «перекрытия» и «разрыва».
Внутри тропоколлагенов существует ковалентная связь между цепями, а также некоторое непостоянное количество данных связей между самими тропоколагеновыми спиралями, образующими хорошо организованные структуры (например, фибриллы). Более толстые пучки фибрилл формируются с помощью белков нескольких других классов, включая другие типы коллагенов, гликопротеины, протеогликаны, использующихся для формирования различных типов тканей из разных комбинаций одних и тех же основных белков. Нерастворимость коллагена была препятствием к изучению мономера коллагена, до того момента как было обнаружено, что возможно извлечь тропоколлаген молодого животного, поскольку он ещё не образовал сильных связей с другими субъединицами фибриллы. Тем не менее, усовершенствование микроскопов и рентгеновских аппаратов облегчили исследования, появлялось всё больше подробных изображений структуры молекулы коллагена. Эти поздние открытия очень важны для лучшего понимания того, как структура коллагена влияет на связи между клетками и межклеточным веществом, как ткани меняются во время роста и регенерации, как они меняются во время эмбрионального развития и при патологии.
Коллагеновая фибрилла — это полукристаллическая структурная единица коллагена. Коллагеновые волокна — это пучки фибрилл.
Использование
Пищевая промышленность
С точки зрения питания, коллаген и желатин являются белками низкого качества, так как они не содержат всех незаменимых аминокислот, необходимых человеку — это неполноценные белки. Производители основанных на коллагене пищевых добавок утверждают, что их продукты могут улучшить качество кожи и ногтей, а также здоровье суставов[источник не указан 3466 дней].
Относительно дешёвые, часто предлагаемые сегодня на рынке под видом источника свободных аминокислот гидролизаты коллагена не всегда способны удовлетворить потребности человека в свободных аминокислотах, так как эти продукты не содержат готовые к усвоению аминокислоты, а являются лишь частично «переваренными» экстрактами суставных тканей млекопитающих, птиц или обитателей моря. Например, гидролизаты коллагена почти полностью лишены аминокислоты L-глютамина, не отличающейся стойкостью к термическому воздействию и долгому хранению сырья, большая часть глютамина разрушается уже на первых этапах хранения и переработки сырья, имеющийся небольшой остаток практически полностью распадается во время термической экстракции хрящевой ткани.
Наиболее качественными источниками аминокислот являются препараты, содержащие так называемые «свободные аминокислоты». Так как именно свободные аминокислоты являются практически готовыми к усвоению, организму не нужно тратить пищеварительные ферменты, время и энергию на их переваривание. Они способны в кратчайшие сроки поступить в кровь и, будучи доставленными ею к местам, нуждающимся в дополнительном синтезе коллагена, тут же включаются в его формирование[источник не указан 3202 дня].
Косметические средства
Коллаген входит в состав косметических средств для:
- Образования воздухопроницаемого, влагоудерживающего слоя на поверхности кожи, обладающего пластифицирующими (разглаживающими) свойствами, со свойствами влажного компресса;
- Продления действия экстрактов, масел и др. в составе косметических композиций;
- Придания блеска волосам, создания коллагенового (защитного) слоя на поверхности волос.
Научные исследования
В 2005 году учёным удалось выделить коллаген из сохранившихся мягких тканей тираннозавра[5][нет в источнике] и использовать его химический состав как ещё одно доказательство родства динозавров с современными птицами[6].
Научные исследования в медицине
Синтез коллагена — сложный ферментативный многостадийный процесс, который должен быть обеспечен достаточным количеством витаминов и минеральных элементов. Синтез протекает в фибробласте и ряд стадий вне фибробласта. Важный момент в синтезе — реакции гидроксилирования, которые открывают путь дальнейшим модификациям, необходимым для созревания коллагена. Катализируют реакции гидроксилирования специфические ферменты. Так, образование 4-оксипролина катализирует пролингидроксилаза, в активном центре которой находится железо. Фермент активен в том случае, если железо находится в двухвалентной форме, что обеспечивается аскорбиновой кислотой (витамин C). Дефицит аскорбиновой кислоты нарушает процесс гидроксилирования, что влияет на дальнейшие стадии синтеза коллагена: гликозилирование, отщепление N- и С-концевых пептидов и др. В результате синтезируется аномальный коллаген, более рыхлый. Эти изменения лежат в основе развития цинги. Коллаген и эластин формируют своеобразную «основу» кожи, которая предотвращает её обвисание, обеспечивает её эластичность и упругость. Эластин как белок прекращает выработку ферментов в человеческом организме в 14 лет, а коллаген — в 21—25, после чего кожные покровы не восстанавливаются и кожа стареет. Также важнейшим компонентом соединительной ткани является кератин — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога, перья и др.
Фотография
Белок является основой для фотографической желатины, которая вместе с микрокристаллами галогенидов серебра образует фотографическую эмульсию. При получении фотографической желатины коллаген денатурируют кислотой или щёлочью. Фотографическая эмульсия, нанесённая тонким слоем на целлулоидную плёнку, стекло или бумагу, а затем высушенная, — это и есть светочувствительный слой фотоматериала (например, фотоплёнки).
Типы коллагена
В настоящее время описано 28 типов коллагена, которые кодируются более чем 40 генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации — интенсивности гидроксилирования или гликозилирования. Общим для всех коллагенов является существование 1 или более доменов, содержащих тройную спираль и присутствие их во внеклеточном матриксе. Более 90 % всего коллагена высших организмов приходится на коллагены I, II,III и IV типов.
| Разновидности коллагена | Типы |
|---|---|
| Фибриллярные коллагены | I, II, III, V, XI, XXIV, XXVII |
| Фибрилл-ассоциированные коллагены (FACIT) | IX, XII, XIV, XVI, XIX, XX, XXI, XXII |
| Коллагены, формирующие филаменты- бусины (beaded filament forming) | VI |
| Сетеобразующие коллагены | IV, VIII, X |
| Коллаген, формирующий якорные фибриллы | VII |
| Трансмембранные коллагены | XIII, XVII, XXIII, XXV/CLAC-P |
| Другие коллагены | XXVIII, XV, XVIII |
Кроме коллагеновых белков существует множество других белков, содержащих в своей структуре домен с тройной коллагеновой спиралью[7][8]. И, тем не менее, их не причисляют к коллагенам, а только к «коллагеноподобным». К большой группе коллагеноподобных белков относятся подкомпонент C1q-комплемента, C1q-подобный фактор, адипонектин, колектины и фиколины, концевая структура ацетилхолинестаразы, три макрофаговых рецептора, эктодисплазин и EMILIN. Эти белки, так же как и коллагены, играют структурную и регуляторную роль.
Коллаген первого типа, самый архетипичный, является тримерным белком, собирающимся в тройные спирали без разрывов, самособирающимся в фибриллы и обладающим наибольшей механической прочностью. Между тем, все остальные коллагены отличаются от него в одном или нескольких аспектах. Некоторые коллагены имеют разрывы в тройной спирали и не обязательно собираются в фибриллы.
| Тип коллагена | Гены | Молекулы | Органы | Ассоциированные болезни |
|---|---|---|---|---|
| I | COL1A1 COL1A2 | α1(I)2α2(I), α1(I)3 | Повсеместно в мягких и твёрдых тканях, в коже, костях, роговице глаза, в склере, в стенке артерий и др. | Синдром Элерса-Данлоса, остеогенез, ревматизм, синдром Марфана, дисплазии |
| II | COL2A1 | α1(II)3 + см тип XI | Гиалиновые и фиброзные хрящи, стекловидное тело, роговица | Коллагенопатия II и XI типа, синдром Стиклера, ахондрогенез |
| III | COL3A1 | α1(III)3 | Дерма кожи плода, стенки крупных кровеносных сосудов, ретикулярные волокна органов кроветворения | Синдром Элерса-Данлоса, фибромышечная дисплазия, аневризма аорты |
| IV | COL4A1 COL4A2 COL4A3 COL4A4 COL4A5 COL4A6 | α1(IV)2α2(IV), другие непонятно | Базальные мембраны, капсула хрусталика | Синдром Альпорта, синдроме Гудпасчера |
| V | COL5A1 COL5A2 COL5A3 | α1(V)2α2(V), α1(V)α2(V)α3(V) + см тип XI | Мягкие ткани, плацента, сосуды, хорион | Синдром Элерса-Данлоса |
| VI | COL6A1 COL6A2 COL6A3 COL6A4 COL6A5 COL6A6 | α1(VI)α2(VI)α3(VI) | Микрофибриллы в мягких тканях и хрящах | Миопатия Ульриха, миопатия Бэтлема, атопический дерматит |
| VII | COL7A1 | α1(VII)3 | Якорные фибриллы в связке кожи и эпидермиса | Буллезный эпидермолиз |
| VIII | COL8A1 COL8A2 | α1(VIII)α2(VIII) | Роговица, эндотелий | Дистрофия роговицы |
| IX | COL9A1 COL9A2 COL9A3 | α1(IX)α2(IX)α3(IX) | Хрящи, стекловидное тело | Синдром Стиклера, остеоартрит, эпифизарная дисплазия |
| X | COL10A1 | α1(X)3 | Гипертрофическая зона области роста | Метафизарная дисплазия Шмида |
| XI | COL11A1 COL11A2 | α1(XI)α2(XI)α1(II), α1(XI)α2(V)α1(II) | Хрящи, стекловидное тело | Коллагенопатия II и XI типов, остеопороз |
| XII | COL12A1 | α1(XII)3 | Мягкие ткани | Повреждения сухожилий |
| XIII | COL13A1 | α1(XIII)3 | Поверхность клеток, эпителиальные клетки | |
| XIV | COL14A1 | α1(IV)3 | Мягкие ткани | |
| XV | COL15A1 | α1(XV)3 | Эндотелиальные клетки | Карцинома |
| XVI | COL16A1 | α1(XVI)3 | Повсеместно | |
| XVII | COL17A1 | α1(XVII)3 | Поверхность эпидермальных клеток | Буллезный эпидермиолиз, пузырчатка |
| XVIII | COL18A1 | α1(XVIII)3 | Эндотелиальные клетки | |
| XIX | COL19A1 | α1(XIX)3 | Повсеместно | Меланома, карцинома |
| XX | COL20A1 | α1(XX)3 | Выделен из куриного эмбриона | |
| XXI | COL21A1 | α1(XXI)3 | Кровеносные сосуды | |
| XXII | COL22A1 | α1(XXII)3 | Только в местах мышечно-сухожильных соединений | |
| XXIII | COL23A1 | α1(XXIII)3 | Опухолевые клетки | |
| XXIV | COL24A1 | α1(XXIV)3 | Формирующиеся кости | Остеохондроз |
| XXV | COL25A1 | α1(XXV)3 | Атеросклеротические бляшки | Болезнь Альцгеймера |
| XXVI | COL26A1=EMID2 | α1(XXVI)3 | Половые органы | |
| XXVII | COL27A1 | α1(XXVII)3 | Мягкие ткани | |
| XXVIII | COL28A1 | α1(XXVIII)3 | Нервная система |
Медицинские аспекты
Нарушения синтеза коллагена в организме лежат в основе таких наследственных заболеваний, как дерматоспораксис у животных, латиризм (характерна разболтанность суставов, привычные вывихи), синдром Элерса-Данлоса (до 14 типов проявлений), несовершенный остеогенез (болезнь «стеклянного человека», врождённый рахит, врождённая ломкость костей), болезнь Марфана, муковисцидоз.
Характерным проявлением этих заболеваний является повреждение связочного аппарата, хрящей, костной системы, наличие пороков сердечных клапанов.
Болезни, вызванные дефектами при биосинтезе коллагена, в том числе так называемые коллагенозы, возникают из-за множества причин. Это может быть из-за мутации в гене, кодирующем аминокислотную последовательность ферментов, продуцирующих коллаген, приводящей к изменению формы коллагеновой молекулы, или ошибки в посттранстляционной модификации коллагена. Также болезни могут быть вызваны недостатком или «неправильной работой» ферментов, вовлечённых в биосинтез коллагена — дефицит ферментов гидроксилирования (пролин-, лизингидроксилазы), гликозилтрансфераз, N-проколлагеновой и С-проколлагеновой пептидаз, лизилоксидаз с последующим нарушением поперечных сшивок, дефицит меди, витаминов B6, B13 (оротовая кислота), C. При приобретённых болезнях, таких как цинга, восстановление баланса ферментов до нормального может привести к полному излечению.
Практически любая генная мутация ведёт к утрате или изменению функций коллагена, что, в свою очередь, отражается на свойствах тканей и органов. Генные мутации в коллагеновом домене могут привести к изменению формы тройной спирали путём вставки/выпадения аминокислоты из полипептидной цепочки или замены Gly на другое основание. Мутации в неколлагеновых доменах могут привести к неправильной пространственной сборке α-цепей в надмолекулярные структуры (фибриллы или сети), что также ведёт к утрате функций. Мутантные α-цепи способны образовывать трёхспиральный комплекс с нормальными α-цепями. В большинстве случаев, такие комплексы нестабильны и быстро разрушаются, однако, такая молекула может и нормально выполнять свою роль, если не затронуты функционально важные области. Большинство болезней, вызванных мутациями в «коллагеновых» генах, являются доминантными.
Примечания
- ↑ Fibrillar collagen: the key to vertebrate evolution? A tale of molecular incest. Boot-Handford RP, Tuckwell DS. Bioessays. 2003 Feb;25(2):142-51.
- ↑ Di Lullo, Gloria A.; Sweeney, Shawn M.; Körkkö, Jarmo; Ala-Kokko, Leena; San Antonio, James D. Mapping the Ligand-binding Sites and Disease-associated Mutations on the Most Abundant Protein in the Human, Type I Collagen (англ.) // Journal of Biological Chemistry|J. Biol. Chem. : journal. — 2002. — Vol. 277, no. 6. — P. 4223—4231. — DOI:10.1074/jbc.M110709200. — PMID 11704682.
- ↑ 1 2 Тропоколлаген (Tropocollagen) в словаре dic.academic.ru
- ↑ XuMuK.ru — КОЛЛАГЕН — Химическая энциклопедия
- ↑ Би-би-си | Наука и техника | Найдены мягкие ткани тираннозавра? — 25 марта 2005 г.
- ↑ Элементы — новости науки: Коллаген из костей динозавров — это уже реальность. — 20.04.07
- ↑ Franzke CW, Bruckner P, Bruckner-Tuderman L. Collagenous transmembrane proteins: recent insights into biology and pathology. J Biol Chem. 2005 Feb 11;280(6):4005-8.
- ↑ Hoppe HJ, Reid KB. Collectins—soluble proteins containing collagenous regions and lectin domains—and their roles in innate immunity. Protein Sci. 1994 Aug;3(8):1143-58

