Молекула коллагена – Коллаген — БИОХИМИЯ МЕЖКЛЕТОЧНОГО МАТРИКСА — БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ — Е. С. Северина
Коллаген — Википедия
Коллаген — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у многоклеточных животных; отсутствует у растений, бактерий, вирусов, простейших и грибов[1]. Коллаген — основной компонент соединительной ткани и самый распространённый белок у млекопитающих[2], составляющий от 25 % до 45% белков во всём теле.
История исследования
Учёные десятилетиями не могли понять молекулярное строение коллагена. Первое доказательство того, что коллаген имеет постоянное строение на молекулярном уровне, было представлено в середине 1930-х годов. С того времени много выдающихся учёных, включая Нобелевских лауреатов, таких как Фрэнсис Крик, Лайнус Полинг, Александр Рич, Ада Йонат, Хелен Берман, Вилеайнур Рамачандран, работали над строением мономера коллагена.
Несколько противоречащих друг другу моделей (несмотря на известное строение каждой отдельной пептидной цепи) дали дорогу для создания троично-спиральной модели, объяснившей четвертичное строение молекулы коллагена.
Свойства
Продуктом денатурации коллагена является желатин. Температура денатурации макромолекулы коллагена близка к температуре фибриллогенеза. Это свойство молекулы коллагена делает её максимально чувствительной к мутационным заменам.
Структура
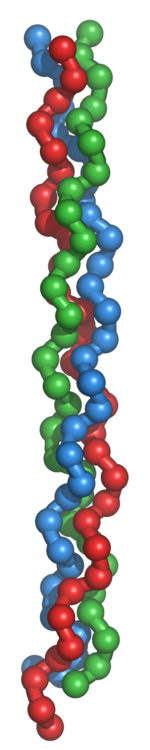
Молекула коллагена представляет собой левозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген[3]. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм.
Для первичной структуры белка характерно высокое содержание глицина, низкое содержание серосодержащих аминокислот и отсутствие триптофана. Коллаген относится к тем немногим белкам животного происхождения, которые содержат остатки нестандартных аминокислот: около 21 % от общего числа остатков приходится на 3-гидроксипролин, 4-гидроксипролин и 5-гидроксилизин
Коллаген существует в нескольких формах. Основа строения всех видов коллагена является схожей. Коллагеновые волокна образуются путём агрегации микрофибрилл, имеют розовый цвет при окраске гематоксилином и эозином и голубой или зелёный при различных трёххромных окрасках, при импрегнации серебром окрашиваются в буро-жёлтый цвет.
Фибриллярная структура
Тропоколлагены (структурные единицы коллагена) спонтанно объединяются, прикрепляясь друг к другу смещенными на определённое расстояние концами, образуя в межклеточном веществе более крупные структуры. В фибриллярных коллагенах молекулы смещены относительно друг друга примерно на 67нм (единица, которая обозначается буквой «D» и меняется в зависимости от состояния гидратации вещества). В целом каждый D-период содержит четыре целых и часть пятой молекулы коллагена. Величина 300 нм, поделенная на 67 нм (300:67) не дают целого числа и длина молекулы коллагена разделена на непостоянные по величине отрезки D. Следовательно, в разрезе каждого повтора D-периода микрофибриллы есть часть, состоящая из пяти молекул, называемая «перекрытие», и часть, состоящая из четырёх молекул — «разрыв». Тропоколлагены к тому же скомпонованы в шестиугольную или псевдошестиугольную (в поперечном разрезе) конструкцию, в каждой области «перекрытия» и «разрыва».
Внутри тропоколлагенов существует ковалентная связь между цепями, а также некоторое непостоянное количество данных связей между самими тропоколагеновыми спиралями, образующими хорошо организованные структуры (например, фибриллы). Более толстые пучки фибрилл формируются с помощью белков нескольких других классов, включая другие типы коллагенов, гликопротеины, протеогликаны, использующихся для формирования различных типов тканей из разных комбинаций одних и тех же основных белков. Нерастворимость коллагена была препятствием к изучению мономера коллагена, до того момента как было обнаружено, что возможно извлечь тропоколлаген молодого животного, поскольку он ещё не образовал сильных связей с другими субъединицами фибриллы. Тем не менее, усовершенствование микроскопов и рентгеновских аппаратов облегчили исследования, появлялось все больше подробных изображений структуры молекулы коллагена. Эти поздние открытия очень важны для лучшего понимания того, как структура коллагена влияет на связи между клетками и межклеточным веществом, как ткани меняются во время роста и регенерации, как они меняются во время эмбрионального развития и при патологии.
Коллагеновая фибрилла — это полукристаллическая структурная единица коллагена. Коллагеновые волокна — это пучки фибрилл.
Использование
Пищевая промышленность
С точки зрения питания, коллаген и желатин являются белками низкого качества, так как они не содержат всех незаменимых аминокислот, необходимых человеку — это неполноценные белки. Производители основанных на коллагене пищевых добавок утверждают, что их продукты могут улучшить качество кожи и ногтей, а также здоровье суставов[источник не указан 3056 дней].
Относительно дешёвые, часто предлагаемые сегодня на рынке под видом источника свободных аминокислот гидролизаты коллагена не всегда способны удовлетворить потребности человека в свободных аминокислотах, так как эти продукты не содержат готовые к усвоению аминокислоты, а являются лишь частично «переваренными» экстрактами суставных тканей млекопитающих, птиц или обитателей моря. Например, гидролизаты коллагена почти полностью лишены аминокислоты L-глютамина, не отличающейся стойкостью к термическому воздействию и долгому хранению сырья, большая часть глютамина разрушается уже на первых этапах хранения и переработки сырья, имеющийся небольшой остаток практически полностью распадается во время термической экстракции хрящевой ткани.
Наиболее качественными источниками аминокислот являются препараты, содержащие так называемые «свободные аминокислоты». Так как именно свободные аминокислоты являются практически готовыми к усвоению, организму не нужно тратить пищеварительные ферменты, время и энергию на их переваривание. Они способны в кратчайшие сроки поступить в кровь и, будучи доставленными ею к местам, нуждающимся в дополнительном синтезе коллагена, тут же включаются в его формирование
Косметические средства
Коллаген входит в состав косметических средств для :
- Образования воздухопроницаемого, влагоудерживающего слоя на поверхности кожи, обладающего пластифицирующими (разглаживающими) свойствами, со свойствами влажного компресса;
- Продления действия экстрактов, масел и др. в составе косметических композиций;
- Придания блеска волосам, создания коллагенового (защитного) слоя на поверхности волос.
Научные исследования
В 2005 году учёным удалось выделить коллаген из сохранившихся мягких тканей тираннозавра[5][нет в источнике] и использовать его химический состав как ещё одно доказательство родства динозавров с современными птицами[6].
Научные исследования в медицине
Синтез коллагена — сложный ферментативный многостадийный процесс, который должен быть обеспечен достаточным количеством витаминов и минеральных элементов. Синтез протекает в фибробласте и ряд стадий вне фибробласта. Важный момент в синтезе — реакции гидроксилирования, которые открывают путь дальнейшим модификациям, необходимым для созревания коллагена. Катализируют реакции гидроксилирования специфические ферменты. Так, образование 4-оксипролина катализирует пролингидроксилаза, в активном центре которой находится железо. Фермент активен в том случае, если железо находится в двухвалентной форме, что обеспечивается аскорбиновой кислотой (витамин С). Дефицит аскорбиновой кислоты нарушает процесс гидроксилирования, что влияет на дальнейшие стадии синтеза коллагена: гликозилирование, отщепление N- и С-концевых пептидов и др. В результате синтезируется аномальный коллаген, более рыхлый. Эти изменения лежат в основе развития цинги. Коллаген и эластин формируют своеобразную «основу» кожи, которая предотвращает её обвисание, обеспечивает её эластичность и упругость. Эластин как белок прекращает выработку ферментов в человеческом организме в 14 лет, а коллаген — в 21—25, после чего кожные покровы не восстанавливаются и кожа стареет. Также важнейшим компонентом соединительной ткани является кератин — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога, перья и др.
Фотография
Белок является основой для фотографической желатины, которая вместе с микрокристаллами галогенидов серебра образует фотографическую эмульсию. При получении фотографической желатины коллаген денатурируют кислотой или щёлочью. Фотографическая эмульсия, нанесённая тонким слоем на целлулоидную плёнку, стекло или бумагу, а затем высушенная, — это и есть светочувствительный слой фотоматериала (например, фотоплёнки).
Типы коллагена
В настоящее время описано 28 типов коллагена, которые кодируются более чем 40 генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации — интенсивности гидроксилирования или гликозилирования. Общим для всех коллагенов является существование 1 или более доменов, содержащих тройную спираль и присутствие их во внеклеточном матриксе. Более 90 % всего коллагена высших организмов приходится на коллагены I, II,III и IV типов.
| Разновидности коллагена | Типы |
|---|---|
| Фибриллярные коллагены | I, II, III, V, XI, XXIV, XXVII |
| Фибрилл-ассоциированные коллагены (FACIT) | IX, XII, XIV, XVI, XIX, XX, XXI, XXII |
| Коллагены, формирующие филаменты- бусины (beaded filament forming) | VI |
| Сетеобразующие коллагены | IV, VIII, X |
| Коллаген, формирующий якорные фибриллы | VII |
| Трансмембранные коллагены | XIII, XVII, XXIII, XXV/CLAC-P |
| Другие коллагены | XXVIII, XV, XVIII |
Кроме коллагеновых белков существует множество других белков, содержащих в своей структуре домен с тройной коллагеновой спиралью[7][8]. И, тем не менее, их не причисляют к коллагенам, а только к «коллагеноподобным». К большой группе коллагеноподобных белков относятся подкомпонент C1q-комплемента, C1q-подобный фактор, адипонектин, колектины и фиколины, концевая структура ацетилхолинестаразы, три макрофаговых рецептора, эктодисплазин и EMILIN. Эти белки, так же как и коллагены, играют структурную и регуляторную роль.
Коллаген первого типа, самый архетипичный, является тримерным белком, собирающимся в тройные спирали без разрывов, самособирающимся в фибриллы и обладающим наибольшей механической прочностью. Между тем, все остальные коллагены отличаются от него в одном или нескольких аспектах. Некоторые коллагены имеют разрывы в тройной спирали и не обязательно собираются в фибриллы.
| Тип коллагена | Гены | Молекулы | Органы | Ассоциированные болезни |
|---|---|---|---|---|
| I | COL1A1 COL1A2 | α1(I)2α2(I), α1(I)3 | Повсеместно в мягких и твёрдых тканях, в коже, костях, роговице глаза, в склере, в стенке артерий и др. | Синдром Элерса-Данлоса, остеогенез, ревматизм, синдром Марфана, дисплазии |
| II | COL2A1 | α1(II)3 + см тип XI | Гиалиновые и фиброзные хрящи, стекловидное тело, роговица | Коллагенопатия II и XI типа, синдром Стиклера, ахондрогенез |
| III | COL3A1 | α1(III)3 | Дерма кожи плода, стенки крупных кровеносных сосудов, ретикулярные волокна органов кроветворения | Синдром Элерса-Данлоса, фибромышечная дисплазия, аневризма аорты |
| IV | COL4A1 COL4A2 COL4A3 COL4A4 COL4A5 COL4A6 | α1(IV)2α2(IV), другие непонятно | Базальные мембраны, капсула хрусталика | Синдром Альпорта, синдроме Гудпасчера |
| V | COL5A1 COL5A2 COL5A3 | α1(V)2α2(V), α1(V)α2(V)α3(V) + см тип XI | Мягкие ткани, плацента, сосуды, хорион | Синдром Элерса-Данлоса |
| VI | COL6A1 COL6A2 COL6A3 COL6A4 COL6A5 COL6A6 | α1(VI)α2(VI)α3(VI) | Микрофибриллы в мягких тканях и хрящах | Миопатия Ульриха, миопатия Бэтлема, атопический дерматит |
| VII | COL7A1 | α1(VII)3 | Якорные фибриллы в связке кожи и эпидермиса | Буллезный эпидермолиз |
| VIII | COL8A1 COL8A2 | α1(VIII)α2(VIII) | Роговица, эндотелий | Дистрофия роговицы |
| IX | COL9A1 COL9A2 COL9A3 | α1(IX)α2(IX)α3(IX) | Хрящи, стекловидное тело | Синдром Стиклера, остеоартрит, эпифизарная дисплазия |
| X | COL10A1 | α1(X)3 | Гипертрофическая зона области роста | Метафизарная дисплазия Шмида |
| XI | COL11A1 COL11A2 | α1(XI)α2(XI)α1(II), α1(XI)α2(V)α1(II) | Хрящи, стекловидное тело | Коллагенопатия II и XI типов, остеопороз |
| XII | COL12A1 | α1(XII)3 | Мягкие ткани | Повреждения сухожилий |
| XIII | COL13A1 | α1(XIII)3 | Поверхность клеток, эпителиальные клетки | |
| XIV | COL14A1 | α1(IV)3 | Мягкие ткани | |
| XV | COL15A1 | α1(XV)3 | Эндотелиальные клетки | Карцинома |
| XVI | COL16A1 | α1(XVI)3 | Повсеместно | |
| XVII | COL17A1 | α1(XVII)3 | Поверхность эпидермальных клеток | Буллезный эпидермиолиз, пузырчатка |
| XVIII | COL18A1 | α1(XVIII)3 | Эндотелиальные клетки | |
| XIX | COL19A1 | α1(XIX)3 | Повсеместно | Меланома, карцинома |
| XX | COL20A1 | α1(XX)3 | Выделен из куриного эмбриона | |
| XXI | COL21A1 | α1(XXI)3 | Кровеносные сосуды | |
| XXII | COL22A1 | α1(XXII)3 | Только в местах мышечно-сухожильных соединений | |
| XXIII | COL23A1 | α1(XXIII)3 | Опухолевые клетки | |
| XXIV | COL24A1 | α1(XXIV)3 | Формирующиеся кости | Остеохондроз |
| XXV | COL25A1 | α1(XXV)3 | Атеросклеротические бляшки | Болезнь Альцгеймера |
| XXVI | COL26A1=EMID2 | α1(XXVI)3 | Половые органы | |
| XXVII | COL27A1 | α1(XXVII)3 | Мягкие ткани | |
| XXVIII | COL28A1 | α1(XXVIII)3 | Нервная система |
Медицинские аспекты
Нарушения синтеза коллагена в организме лежат в основе таких наследственных заболеваний, как дерматоспораксис у животных, латиризм (характерна разболтанность суставов, привычные вывихи), синдром Элерса-Данлоса (до 14 типов проявлений), несовершенный остеогенез (болезнь «стеклянного человека», врождённый рахит, врождённая ломкость костей), болезнь Марфана.
Характерным проявлением этих заболеваний является повреждение связочного аппарата, хрящей, костной системы, наличие пороков сердечных клапанов.
Болезни, вызванные дефектами при биосинтезе коллагена, в том числе так называемые коллагенозы, возникают из-за множества причин. Это может быть из-за мутации в гене, кодирующем аминокислотную последовательность ферментов, продуцирующих коллаген, приводящей к изменению формы коллагеновой молекулы, или ошибки в посттранстляционной модификации коллагена. Также болезни могут быть вызваны недостатком или «неправильной работой» ферментов, вовлеченных в биосинтез коллагена — дефицит ферментов гидроксилирования (пролин-, лизингидроксилазы), гликозилтрансфераз, N-проколлагеновой и С-проколлагеновой пептидаз, лизилоксидаз с последующим нарушением поперечных сшивок, дефицит меди, витаминов В6, В13 (оротовая кислота), C. При приобретённых болезнях, таких как цинга, восстановление баланса ферментов до нормального может привести к полному излечению.
Практически любая генная мутация ведёт к утрате или изменению функций коллагена, что, в свою очередь, отражается на свойствах тканей и органов. Генные мутации в коллагеновом домене могут привести к изменению формы тройной спирали путём вставки/выпадения аминокислоты из полипептидной цепочки или замены Gly на другое основание. Мутации в неколлагеновых доменах могут привести к неправильной пространственной сборке α-цепей в надмолекулярные структуры (фибриллы или сети), что также ведёт к утрате функций. Мутантные α-цепи способны образовывать трёхспиральный комплекс с нормальными α-цепями. В большинстве случаев, такие комплексы нестабильны и быстро разрушаются, однако, такая молекула может и нормально выполнять свою роль, если не затронуты функционально важные области. Большинство болезней, вызванных мутациями в «коллагеновых» генах, являются доминантными.
Примечания
Ссылки
Коллаген — это… Что такое Коллаген?
Коллаге́н — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у многоклеточных животных; отсутствует у растений, бактерий, вирусов, простейших и грибов.[1] Это основной компонент соединительной ткани и самый распространённый протеин у млекопитающих,[2] составляющий от 25% до 35% протеинов во всём теле.
История исследования
Учёные десятилетиями не могли понять молекулярное строение коллагена. Первое доказательство того, что коллаген имеет постоянную структуру на молекулярном уровне, было представлено в середине 30-х годов прошлого века. С того времени много выдающихся учёных, включая Нобелевских лауреатов, таких как Фрэнсис Крик, Лайнус Полинг, Александр Рич, Ада Йонат, Хелен Берман, Вилеайнур Рамачандран работали над строением мономера коллагена.
Несколько противоречащих друг другу моделей (несмотря на известную структуру каждой отдельной пептидной цепи) дали дорогу для создания троично-спиральной модели, объяснившей четвертичную структуру молекулы коллагена.
Свойства
Продуктом денатурации коллагена является желатин. Температура денатурации макромолекулы коллагена близка к температуре фибриллогенеза. Это свойство молекулы коллагена делает её максимально чувствительной к мутационным заменам.
Структура
Молекула коллагена представляет собой правозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген[3]. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм.
Для первичной структуры белка характерно высокое содержание глицина, низкое содержание серосодержащих аминокислот и отсутствие триптофана. Коллаген относится к тем немногим белкам животного происхождения, которые содержат остатки нестандартных аминокислот: около 21 % от общего числа остатков приходится на 3-гидроксипролин, 4-гидроксипролин и 5-гидроксилизин[4]. Каждая из α-цепей состоит из триад аминокислот. В триадах третья аминокислота всегда глицин, вторая — пролин или лизин, первая — любая другая аминокислота, кроме трёх перечисленных[3].
Коллаген существует в нескольких формах. Основная структура всех типов коллагена является схожей. Коллагеновые волокна образуются путём агрегации микрофибрилл, имеют розовый цвет при окраске гематоксилином и эозином и голубой или зелёный при различных треххромных окрасках, при импрегнации серебром окрашиваются в буро-жёлтый цвет.
Фибриллярная структура
Тропоколлаген (структурные единицы коллагена) спонтанно объединяются, прикрепляясь друг к другу смещенными на определённое расстояние концами, образуя в межклеточном веществе более крупные структуры. В фибриллярных коллагенах молекулы смещены относительно друг друга примерно на 67нм (единица, которая обозначается буквой «D» и меняется в зависимости от состояния гидратации вещества). В целом каждый D -период содержит четыре целых и часть пятой молекулы коллагена. Величина 300 нм, поделенная на 67 нм (300:67) не дают целого числа и длина молекулы коллагена разделена на непостоянные по величине отрезки D. Следовательно, в разрезе каждого повтора D -периода микрофибриллы есть часть, состоящая из пяти молекул называемая «перекрытие», и часть, состоящая из четырёх молекул — «разрыв». Тропоколлагены к тому же скомпонованы в шестиугольную или псевдошестиугольную (в поперечном разрезе) конструкцию, в каждой области «перекрытия» и «разрыва».
Внутри тропоколлагенов существует ковалентная связь между цепями, а также некоторое непостоянное количество данных связей между самими тропоколагеновыми спиралями, образующими хорошо организованные структуры (например, фибриллы). Более толстые пучки фибрилл формируются с помощью белков нескольких других классов, включая другие типы коллагенов, гликопротеины, протеогликаны, использующихся для формирования различных типов тканей из разных комбинаций одних и тех же основных белков. Нерастворимость коллагена была препятствием к изучению мономера коллагена, до того момента как было обнаружено, что возможно извлечь тропоколлаген молодого животного, поскольку он ещё не образовал сильных связей с другими субъединицами фибриллы. Тем не менее, усовершествование микроскопов и рентгеновских аппаратов облегчили исследования, появлялось все больше подробных изображений структуры молекулы коллагена. Эти поздние открытия очень важны для лучшего понимания того, как структура коллагена влияет на связи между клетками и межклеточным веществом, как ткани меняются во время роста и регенерации, как они меняются во время эмбрионального развития и при патологии.
Коллагеновая фибрилла — это полукристаллическая структурная единица коллагена. Коллагеновые волокна — это пучки фибрилл.
Использование
Пищевая промышленность
С точки зрения питания, коллаген и желатин являются белками низкого качества, так как они не содержат всех незаменимых аминокислот, необходимых человеку — это неполноценные белки. Производители основанных на коллагене пищевых добавок утверждают, что их продукты могут улучшить качество кожи и ногтей, а также здоровье суставов.[источник не указан 928 дней]
Относительно дешёвые, часто предлагаемые сегодня на рынке под видом источника свободных аминокислот гидролизаты коллагена не всегда способны удовлетворить потребности человека в свободных аминокислотах, так как эти продукты не содержат готовые к усвоению аминокислоты, а является лишь частично “переваренными” экстрактами суставных тканей млекопитающих, птиц или обитателей моря. Например, гидролизаты коллагена почти полностью лишены аминокислоты L-глютамина, не отличающейся стойкостью к термическому воздействию и долгому хранению сырья, большая часть глютамина и разрушается уже на первых этапах хранения и переработки сырья, имеющийся небольшой остаток практически полностью распадается во время термической экстракции хрящевой ткани.
Наиболее качественными источниками аминокислот являются препараты, содержащие так называемые “свободные аминокислоты”. Так как именно свободные аминокислоты являются практически готовыми к усвоению, организму принимающего человека не нужно тратить время, пищеварительные ферменты и энергию на их переваривание. Они способны в кратчайшие сроки поступить в кровь, и будучи доставленными ею к местам, нуждающимся в дополнительном синтезе коллагена, тут же включаются в его формирование.[источник не указан 664 дня]
Косметические средства
Коллаген входит в состав косметических средств для :
- Образования воздухопроницаемого, влагоудерживающго слоя на поверхности кожи, обладающего пластифицирующими (разглаживающими) свойствами, со свойствами влажного компресса;
- Пролонгирования действия экстрактов, масел и др. в составе косметических композиций;
- Придания блеска волосам, создания коллагенового (защитного) слоя на поверхности волос.
Научные исследования
В 2005 году учёным удалось выделить коллаген из сохранившихся мягких тканей тираннозавра[5] и использовать его химический состав как ещё одно доказательство родства динозавров с современными птицами[6].
Научные исследования в медицине
Синтез коллагена — сложный ферментативный многостадийный процесс, который должен быть обеспечен достаточным количеством витаминов и минеральных элементов. Синтез протекает в фибробласте и ряд стадий вне фибробласта. Важный момент в синтезе — реакции гидроксилирования, которые открывают путь дальнейшим модификациям, необходимым для созревания коллагена. Катализируют реакции гидроксилирования специфические ферменты. Так, образование 4-оксипролина катализирует пролингидроксилаза, в активном центре которой находится железо. Фермент активен в том случае, если железо находится в двухвалентной форме, что обеспечивается аскорбиновой кислотой (витамин С). Дефицит аскорбиновой кислоты нарушает процесс гидроксилирования, что влияет на дальнейшие стадии синтеза коллагена- гликозилирование, отщепление N- и С-концевых пептидов и др. В результате синтезируется аномальный коллаген, более рыхлый. Эти изменения лежат в основе развития цинги.
Типы коллагена
В настоящее время описано 28 типов коллагена, которые кодируются более чем 40 генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации — интенсивности гидроксилирования или гликозилирования. Общим для всех коллагенов является существование 1 или более доменов, содержащих тройную спираль и присутствие их во внеклеточном матриксе. Более 90 % всего коллагена высших организмов приходится на коллагены I, II,III и IV типов.
| Разновидности коллагена | Типы |
|---|---|
| Фибриллярные коллагены | I, II, III, V, XI, XXIV, XXVII |
| Фибрилл-ассоциированные коллагены (FACIT) | IX, XII, XIV, XVI, XIX, XX, XXI, XXII |
| Коллагены, формирующие филаменты- бусины (beaded filament forming) | VI |
| Сетеобразующие коллагены | IV, VIII, X |
| Коллаген, формирующий якорные фибриллы | VII |
| Трансмембранные коллагены | XIII, XVII, XXIII, XXV/CLAC-P |
| Другие коллагены | XXVIII, XV, XVIII |
Кроме белков коллагенов существует множество белков, содержащих в своей структуре домен с тройной коллагеновой спиралью[7][8]. И, тем не менее, они не позиционируются как коллагены, а только как «коллагено-подобные». К большой группе коллагено-подобных белков относятся подкомпонент C1q комплемента, C1q подобный фактор, адипонектин, колектины и фиколины, концевая структура ацетилхолинестаразы, три макрофаговых рецептора, эктодисплазин и EMILIN. Эти белки, так же как и коллагены, играют структурную и регуляторную роль.
Коллаген первого типа, самый архетипичный, является тримерным белком, собирающимся в тройные спирали без разрывов, самособирающимся в фибриллы и обладающим наибольшей механической прочностью. Между тем, все остальные коллагены отличаются от него в одном или нескольких аспектах. Некоторые коллагены имеют разрывы в тройной спирали и не обязательно собираются в фибриллы.
| Тип коллагена | Гены | Молекулы | Органы | Ассоциированные болезни |
|---|---|---|---|---|
| I | COL1A1 COL1A2 | α1(I)2α2(I), α1(I)3 | Повсеместно в мягких и твёрдых тканях, в коже, костях | Синдром Элерса-Данлоса, остеогенез, ревматизм, синдром Марфана, дисплазии |
| II | COL2A1 | α1(II)3 + см тип XI | Хрящи, стекловидное тело, межпозвоночные диски | Коллагенопатия II и XI типа, синдром Стиклера, ахондрогенез |
| III | COL3A1 | α1(III)3 | Мягкие ткани и полые органы | Синдром Элерса-Данлоса, фибромышечная дисплазия, аневризма аорты |
| IV | COL4A1 COL4A2 COL4A3 COL4A4 COL4A5 COL4A6 | α1(IV)2α2(IV), другие непонятно | Базальные мембраны | Синдром Альпорта, синдроме Гудпасчера |
| V | COL5A1 COL5A2 COL5A3 | α1(V)2α2(V), α1(V)α2(V)α3(V) + см тип XI | Мягкие ткани, плацента, сосуды, хорион | Синдром Элерса-Данлоса |
| VI | COL6A1 COL6A2 COL6A3 COL6A4 COL6A5 COL6A6 | α1(VI)α2(VI)α3(VI) | Микрофибриллы в мягких тканях и хрящах | Миопатия Ульриха, миопатия Бэтлема, атопический дерматит |
| VII | COL7A1 | α1(VII)3 | Прикрепительные фибриллы в связке кожи и эпидермия | Буллезный эпидермолиз |
| VIII | COL8A1 COL8A2 | α1(VIII)α2(VIII) | Роговица, эндотелий | Дистрофия роговицы |
| IX | COL9A1 COL9A2 COL9A3 | α1(IX)α2(IX)α3(IX) | Хрящи, стекловидное тело | Синдром Стиклера, остеоартрит, эпифизарная дисплазия |
| X | COL10A1 | α1(X)3 | Гипертрофическая зона области роста | Метафизарная дисплазия Шмида |
| XI | COL11A1 COL11A2 | α1(XI)α2(XI)α1(II), α1(XI)α2(V)α1(II) | Хрящи, стекловидно тело | Коллагенопатия II и XI типов, остеопороз |
| XII | COL12A1 | α1(XII)3 | Мягкие ткани | Повреждения сухожилий |
| XIII | COL13A1 | α1(XIII)3 | Поверхность клеток, эпительные клетки | |
| XIV | COL14A1 | α1(IV)3 | Мягкие ткани | |
| XV | COL15A1 | α1(XV)3 | Эндотелиальные клетки | карцинома |
| XVI | COL16A1 | α1(XVI)3 | Повсеместно | |
| XVII | COL17A1 | α1(XVII)3 | Поверхность эпидермальных клеток | Буллезный эпидермиолиз, пузырчатка |
| XVIII | COL18A1 | α1(XVIII)3 | Эндотелиальные клетки | |
| XIX | COL19A1 | α1(XIX)3 | Повсеместно | Меланома, карцинома |
| XX | COL20A1 | α1(XX)3 | Выделен из куриного эмбриона | |
| XXI | COL21A1 | α1(XXI)3 | Кровеносные сосуды | |
| XXII | COL22A1 | α1(XXII)3 | Только в местах мышечно-сухожильных соединений | |
| XXIII | COL23A1 | α1(XXIII)3 | Опухолевые клетки | |
| XXIV | COL24A1 | α1(XXIV)3 | Формирующиеся кости | Остеохондроз |
| XXV | COL25A1 | α1(XXV)3 | Атеросклеротические бляшки | Болезнь Альцгеймера |
| XXVI | COL26A1=EMID2 | α1(XXVI)3 | Половые органы | |
| XXVII | COL27A1 | α1(XXVII)3 | Мягкие ткани | |
| XXVIII | COL28A1 | α1(XXVIII)3 | Нервная система |
Медицинские аспекты
Нарушения синтеза коллагена лежат в основе таких наследственных заболеваний, как дерматоспораксис у животных, латиризм (характерна разболтанность суставов, привычные вывихи), синдром Элерса-Данлоса (до 14 типов проявлений), несовершенный остеогенез (болезнь «стеклянного человека», врожденный рахит, врожденная ломкость костей), болезнь Марфана.
Характерным проявлением этих заболеваний является повреждение связочного аппарата, хрящей, костной системы, наличие пороков сердечных клапанов.
Болезни коллагена, в том числе так называемые коллагенозы, возникают из-за множества причин. Это может быть из-за мутации в гене, приводящей к изменению формы коллагеновой молекулы, или ошибки в пострансляционной модификации коллагена. Также болезни могут быть вызваны недостатком или «неправильной работой» ферментов, вовлеченных в биосинтез коллагена — дефицит ферментов гидроксилирования (пролин-, лизингидроксилазы), гликозилтрансфераз, N-проколлагеновой и С-проколлагеновой пептидаз, лизилоксидаз с последующим нарушением поперечных сшивок, дефицит меди, витаминов В6, C. При приобретённых болезнях, таких как цинга, восстановление баланса ферментов до нормального может привести к полному излечению.
Практически любая генная мутация, ведет к утрате или изменению функций коллагена, что, в свою очередь, отражается на свойствах тканей и органов. Генные мутации в коллагеновом домене могут привести к изменению формы тройной спирали, путём вставки/делеции аминокислоты или замены Gly на другое основание. Мутации в неколлагеновых доменах могут привести к неправильной сборке α-цепей в надмолекулярные структуры (фибриллы или сети), что также ведет к утрате функций. Мутантные a-цепи способны образовывать трех-спиральный комплекс с нормальными a-цепями. В большинстве случаев, такие комплексы не стабильны и быстро разрушаются, однако такая молекула может и нормально выполнять свою роль, если не затронуты функционально важные области. Большинство болезней, вызванных мутациями в коллагеновых генах, являются доминантными.
Примечания
Ссылки
Коллаген — Википедия. Что такое Коллаген
Коллаген — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у многоклеточных животных; отсутствует у растений, бактерий, вирусов, простейших и грибов[1]. Коллаген — основной компонент соединительной ткани и самый распространённый белок у млекопитающих[2], составляющий от 25 % до 45% белков во всём теле.
История исследования
Учёные десятилетиями не могли понять молекулярное строение коллагена. Первое доказательство того, что коллаген имеет постоянное строение на молекулярном уровне, было представлено в середине 1930-х годов. С того времени много выдающихся учёных, включая Нобелевских лауреатов, таких как Фрэнсис Крик, Лайнус Полинг, Александр Рич, Ада Йонат, Хелен Берман, Вилеайнур Рамачандран, работали над строением мономера коллагена.
Несколько противоречащих друг другу моделей (несмотря на известное строение каждой отдельной пептидной цепи) дали дорогу для создания троично-спиральной модели, объяснившей четвертичное строение молекулы коллагена.
Свойства
Продуктом денатурации коллагена является желатин. Температура денатурации макромолекулы коллагена близка к температуре фибриллогенеза. Это свойство молекулы коллагена делает её максимально чувствительной к мутационным заменам.
Структура
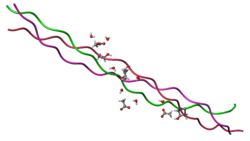
Молекула коллагена представляет собой левозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген[3]. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм.
Для первичной структуры белка характерно высокое содержание глицина, низкое содержание серосодержащих аминокислот и отсутствие триптофана. Коллаген относится к тем немногим белкам животного происхождения, которые содержат остатки нестандартных аминокислот: около 21 % от общего числа остатков приходится на 3-гидроксипролин, 4-гидроксипролин и 5-гидроксилизин[4]. Каждая из α-цепей состоит из триад аминокислот. В триадах третья аминокислота всегда глицин, вторая — пролин или лизин, первая — любая другая аминокислота, кроме трёх перечисленных[3].
Коллаген существует в нескольких формах. Основа строения всех видов коллагена является схожей. Коллагеновые волокна образуются путём агрегации микрофибрилл, имеют розовый цвет при окраске гематоксилином и эозином и голубой или зелёный при различных трёххромных окрасках, при импрегнации серебром окрашиваются в буро-жёлтый цвет.
Фибриллярная структура
Тропоколлагены (структурные единицы коллагена) спонтанно объединяются, прикрепляясь друг к другу смещенными на определённое расстояние концами, образуя в межклеточном веществе более крупные структуры. В фибриллярных коллагенах молекулы смещены относительно друг друга примерно на 67нм (единица, которая обозначается буквой «D» и меняется в зависимости от состояния гидратации вещества). В целом каждый D-период содержит четыре целых и часть пятой молекулы коллагена. Величина 300 нм, поделенная на 67 нм (300:67) не дают целого числа и длина молекулы коллагена разделена на непостоянные по величине отрезки D. Следовательно, в разрезе каждого повтора D-периода микрофибриллы есть часть, состоящая из пяти молекул, называемая «перекрытие», и часть, состоящая из четырёх молекул — «разрыв». Тропоколлагены к тому же скомпонованы в шестиугольную или псевдошестиугольную (в поперечном разрезе) конструкцию, в каждой области «перекрытия» и «разрыва».
Внутри тропоколлагенов существует ковалентная связь между цепями, а также некоторое непостоянное количество данных связей между самими тропоколагеновыми спиралями, образующими хорошо организованные структуры (например, фибриллы). Более толстые пучки фибрилл формируются с помощью белков нескольких других классов, включая другие типы коллагенов, гликопротеины, протеогликаны, использующихся для формирования различных типов тканей из разных комбинаций одних и тех же основных белков. Нерастворимость коллагена была препятствием к изучению мономера коллагена, до того момента как было обнаружено, что возможно извлечь тропоколлаген молодого животного, поскольку он ещё не образовал сильных связей с другими субъединицами фибриллы. Тем не менее, усовершенствование микроскопов и рентгеновских аппаратов облегчили исследования, появлялось все больше подробных изображений структуры молекулы коллагена. Эти поздние открытия очень важны для лучшего понимания того, как структура коллагена влияет на связи между клетками и межклеточным веществом, как ткани меняются во время роста и регенерации, как они меняются во время эмбрионального развития и при патологии.
Коллагеновая фибрилла — это полукристаллическая структурная единица коллагена. Коллагеновые волокна — это пучки фибрилл.
Использование
Пищевая промышленность
С точки зрения питания, коллаген и желатин являются белками низкого качества, так как они не содержат всех незаменимых аминокислот, необходимых человеку — это неполноценные белки. Производители основанных на коллагене пищевых добавок утверждают, что их продукты могут улучшить качество кожи и ногтей, а также здоровье суставов[источник не указан 3049 дней].
Относительно дешёвые, часто предлагаемые сегодня на рынке под видом источника свободных аминокислот гидролизаты коллагена не всегда способны удовлетворить потребности человека в свободных аминокислотах, так как эти продукты не содержат готовые к усвоению аминокислоты, а являются лишь частично «переваренными» экстрактами суставных тканей млекопитающих, птиц или обитателей моря. Например, гидролизаты коллагена почти полностью лишены аминокислоты L-глютамина, не отличающейся стойкостью к термическому воздействию и долгому хранению сырья, большая часть глютамина разрушается уже на первых этапах хранения и переработки сырья, имеющийся небольшой остаток практически полностью распадается во время термической экстракции хрящевой ткани.
Наиболее качественными источниками аминокислот являются препараты, содержащие так называемые «свободные аминокислоты». Так как именно свободные аминокислоты являются практически готовыми к усвоению, организму не нужно тратить пищеварительные ферменты, время и энергию на их переваривание. Они способны в кратчайшие сроки поступить в кровь и, будучи доставленными ею к местам, нуждающимся в дополнительном синтезе коллагена, тут же включаются в его формирование[источник не указан 2785 дней].
Косметические средства
Коллаген входит в состав косметических средств для :
- Образования воздухопроницаемого, влагоудерживающего слоя на поверхности кожи, обладающего пластифицирующими (разглаживающими) свойствами, со свойствами влажного компресса;
- Продления действия экстрактов, масел и др. в составе косметических композиций;
- Придания блеска волосам, создания коллагенового (защитного) слоя на поверхности волос.
Научные исследования
В 2005 году учёным удалось выделить коллаген из сохранившихся мягких тканей тираннозавра[5][нет в источнике] и использовать его химический состав как ещё одно доказательство родства динозавров с современными птицами[6].
Научные исследования в медицине
Синтез коллагена — сложный ферментативный многостадийный процесс, который должен быть обеспечен достаточным количеством витаминов и минеральных элементов. Синтез протекает в фибробласте и ряд стадий вне фибробласта. Важный момент в синтезе — реакции гидроксилирования, которые открывают путь дальнейшим модификациям, необходимым для созревания коллагена. Катализируют реакции гидроксилирования специфические ферменты. Так, образование 4-оксипролина катализирует пролингидроксилаза, в активном центре которой находится железо. Фермент активен в том случае, если железо находится в двухвалентной форме, что обеспечивается аскорбиновой кислотой (витамин С). Дефицит аскорбиновой кислоты нарушает процесс гидроксилирования, что влияет на дальнейшие стадии синтеза коллагена: гликозилирование, отщепление N- и С-концевых пептидов и др. В результате синтезируется аномальный коллаген, более рыхлый. Эти изменения лежат в основе развития цинги. Коллаген и эластин формируют своеобразную «основу» кожи, которая предотвращает её обвисание, обеспечивает её эластичность и упругость. Эластин как белок прекращает выработку ферментов в человеческом организме в 14 лет, а коллаген — в 21—25, после чего кожные покровы не восстанавливаются и кожа стареет. Также важнейшим компонентом соединительной ткани является кератин — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога, перья и др.
Фотография
Белок является основой для фотографической желатины, которая вместе с микрокристаллами галогенидов серебра образует фотографическую эмульсию. При получении фотографической желатины коллаген денатурируют кислотой или щёлочью. Фотографическая эмульсия, нанесённая тонким слоем на целлулоидную плёнку, стекло или бумагу, а затем высушенная, — это и есть светочувствительный слой фотоматериала (например, фотоплёнки).
Типы коллагена
В настоящее время описано 28 типов коллагена, которые кодируются более чем 40 генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации — интенсивности гидроксилирования или гликозилирования. Общим для всех коллагенов является существование 1 или более доменов, содержащих тройную спираль и присутствие их во внеклеточном матриксе. Более 90 % всего коллагена высших организмов приходится на коллагены I, II,III и IV типов.
| Разновидности коллагена | Типы |
|---|---|
| Фибриллярные коллагены | I, II, III, V, XI, XXIV, XXVII |
| Фибрилл-ассоциированные коллагены (FACIT) | IX, XII, XIV, XVI, XIX, XX, XXI, XXII |
| Коллагены, формирующие филаменты- бусины (beaded filament forming) | VI |
| Сетеобразующие коллагены | IV, VIII, X |
| Коллаген, формирующий якорные фибриллы | VII |
| Трансмембранные коллагены | XIII, XVII, XXIII, XXV/CLAC-P |
| Другие коллагены | XXVIII, XV, XVIII |
Кроме коллагеновых белков существует множество других белков, содержащих в своей структуре домен с тройной коллагеновой спиралью[7][8]. И, тем не менее, их не причисляют к коллагенам, а только к «коллагеноподобным». К большой группе коллагеноподобных белков относятся подкомпонент C1q-комплемента, C1q-подобный фактор, адипонектин, колектины и фиколины, концевая структура ацетилхолинестаразы, три макрофаговых рецептора, эктодисплазин и EMILIN. Эти белки, так же как и коллагены, играют структурную и регуляторную роль.
Коллаген первого типа, самый архетипичный, является тримерным белком, собирающимся в тройные спирали без разрывов, самособирающимся в фибриллы и обладающим наибольшей механической прочностью. Между тем, все остальные коллагены отличаются от него в одном или нескольких аспектах. Некоторые коллагены имеют разрывы в тройной спирали и не обязательно собираются в фибриллы.
| Тип коллагена | Гены | Молекулы | Органы | Ассоциированные болезни |
|---|---|---|---|---|
| I | COL1A1 COL1A2 | α1(I)2α2(I), α1(I)3 | Повсеместно в мягких и твёрдых тканях, в коже, костях, роговице глаза, в склере, в стенке артерий и др. | Синдром Элерса-Данлоса, остеогенез, ревматизм, синдром Марфана, дисплазии |
| II | COL2A1 | α1(II)3 + см тип XI | Гиалиновые и фиброзные хрящи, стекловидное тело, роговица | Коллагенопатия II и XI типа, синдром Стиклера, ахондрогенез |
| III | COL3A1 | α1(III)3 | Дерма кожи плода, стенки крупных кровеносных сосудов, ретикулярные волокна органов кроветворения | Синдром Элерса-Данлоса, фибромышечная дисплазия, аневризма аорты |
| IV | COL4A1 COL4A2 COL4A3 COL4A4 COL4A5 COL4A6 | α1(IV)2α2(IV), другие непонятно | Базальные мембраны, капсула хрусталика | Синдром Альпорта, синдроме Гудпасчера |
| V | COL5A1 COL5A2 COL5A3 | α1(V)2α2(V), α1(V)α2(V)α3(V) + см тип XI | Мягкие ткани, плацента, сосуды, хорион | Синдром Элерса-Данлоса |
| VI | COL6A1 COL6A2 COL6A3 COL6A4 COL6A5 COL6A6 | α1(VI)α2(VI)α3(VI) | Микрофибриллы в мягких тканях и хрящах | Миопатия Ульриха, миопатия Бэтлема, атопический дерматит |
| VII | COL7A1 | α1(VII)3 | Якорные фибриллы в связке кожи и эпидермиса | Буллезный эпидермолиз |
| VIII | COL8A1 COL8A2 | α1(VIII)α2(VIII) | Роговица, эндотелий | Дистрофия роговицы |
| IX | COL9A1 COL9A2 COL9A3 | α1(IX)α2(IX)α3(IX) | Хрящи, стекловидное тело | Синдром Стиклера, остеоартрит, эпифизарная дисплазия |
| X | COL10A1 | α1(X)3 | Гипертрофическая зона области роста | Метафизарная дисплазия Шмида |
| XI | COL11A1 COL11A2 | α1(XI)α2(XI)α1(II), α1(XI)α2(V)α1(II) | Хрящи, стекловидное тело | Коллагенопатия II и XI типов, остеопороз |
| XII | COL12A1 | α1(XII)3 | Мягкие ткани | Повреждения сухожилий |
| XIII | COL13A1 | α1(XIII)3 | Поверхность клеток, эпителиальные клетки | |
| XIV | COL14A1 | α1(IV)3 | Мягкие ткани | |
| XV | COL15A1 | α1(XV)3 | Эндотелиальные клетки | Карцинома |
| XVI | COL16A1 | α1(XVI)3 | Повсеместно | |
| XVII | COL17A1 | α1(XVII)3 | Поверхность эпидермальных клеток | Буллезный эпидермиолиз, пузырчатка |
| XVIII | COL18A1 | α1(XVIII)3 | Эндотелиальные клетки | |
| XIX | COL19A1 | α1(XIX)3 | Повсеместно | Меланома, карцинома |
| XX | COL20A1 | α1(XX)3 | Выделен из куриного эмбриона | |
| XXI | COL21A1 | α1(XXI)3 | Кровеносные сосуды | |
| XXII | COL22A1 | α1(XXII)3 | Только в местах мышечно-сухожильных соединений | |
| XXIII | COL23A1 | α1(XXIII)3 | Опухолевые клетки | |
| XXIV | COL24A1 | α1(XXIV)3 | Формирующиеся кости | Остеохондроз |
| XXV | COL25A1 | α1(XXV)3 | Атеросклеротические бляшки | Болезнь Альцгеймера |
| XXVI | COL26A1=EMID2 | α1(XXVI)3 | Половые органы | |
| XXVII | COL27A1 | α1(XXVII)3 | Мягкие ткани | |
| XXVIII | COL28A1 | α1(XXVIII)3 | Нервная система |
Медицинские аспекты
Нарушения синтеза коллагена в организме лежат в основе таких наследственных заболеваний, как дерматоспораксис у животных, латиризм (характерна разболтанность суставов, привычные вывихи), синдром Элерса-Данлоса (до 14 типов проявлений), несовершенный остеогенез (болезнь «стеклянного человека», врождённый рахит, врождённая ломкость костей), болезнь Марфана.
Характерным проявлением этих заболеваний является повреждение связочного аппарата, хрящей, костной системы, наличие пороков сердечных клапанов.
Болезни, вызванные дефектами при биосинтезе коллагена, в том числе так называемые коллагенозы, возникают из-за множества причин. Это может быть из-за мутации в гене, кодирующем аминокислотную последовательность ферментов, продуцирующих коллаген, приводящей к изменению формы коллагеновой молекулы, или ошибки в посттранстляционной модификации коллагена. Также болезни могут быть вызваны недостатком или «неправильной работой» ферментов, вовлеченных в биосинтез коллагена — дефицит ферментов гидроксилирования (пролин-, лизингидроксилазы), гликозилтрансфераз, N-проколлагеновой и С-проколлагеновой пептидаз, лизилоксидаз с последующим нарушением поперечных сшивок, дефицит меди, витаминов В6, В13 (оротовая кислота), C. При приобретённых болезнях, таких как цинга, восстановление баланса ферментов до нормального может привести к полному излечению.
Практически любая генная мутация ведёт к утрате или изменению функций коллагена, что, в свою очередь, отражается на свойствах тканей и органов. Генные мутации в коллагеновом домене могут привести к изменению формы тройной спирали путём вставки/выпадения аминокислоты из полипептидной цепочки или замены Gly на другое основание. Мутации в неколлагеновых доменах могут привести к неправильной пространственной сборке α-цепей в надмолекулярные структуры (фибриллы или сети), что также ведёт к утрате функций. Мутантные α-цепи способны образовывать трёхспиральный комплекс с нормальными α-цепями. В большинстве случаев, такие комплексы нестабильны и быстро разрушаются, однако, такая молекула может и нормально выполнять свою роль, если не затронуты функционально важные области. Большинство болезней, вызванных мутациями в «коллагеновых» генах, являются доминантными.
Примечания
Ссылки
Коллаген Википедия

Коллаге́н — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у животных; отсутствует у растений, бактерий, вирусов, простейших и грибов[1]. Коллаген — основной компонент соединительной ткани и самый распространённый белок у млекопитающих[2], составляющий от 25 % до 45% белков во всём теле. Синтез коллагена очень энергозатратный и происходит только у животных, которые используют свободный кислород. Появление коллагена позволило создать скелет, как внешний и внутренний, и резко увеличить размеры животных во время Кембрийского взрыва.
История исследования
Учёные десятилетиями не могли понять молекулярное строение коллагена. Первое доказательство того, что коллаген имеет постоянное строение на молекулярном уровне, было представлено в середине 1930-х годов. С того времени много выдающихся учёных, включая Нобелевских лауреатов, таких как Фрэнсис Крик, Лайнус Полинг, Александр Рич, Ада Йонат, Хелен Берман, Вилеайнур Рамачандран, работали над строением мономера коллагена.
Несколько противоречащих друг другу моделей (несмотря на известное строение каждой отдельной пептидной цепи) дали дорогу для создания троично-спиральной модели, объяснившей четвертичное строение молекулы коллагена.
Свойства
Продуктом денатурации коллагена является желатин. Температура денатурации макромолекулы коллагена близка к температуре фибриллогенеза. Это свойство молекулы коллагена делает её максимально чувствительной к мутационным заменам.
Фибриллогенез — образование коллагеновых волокон в соединительной ткани путём сборки или объединения в пучки фибрилл — тонких белковых нитевидных структур внутри клетки и тканей человеческого организма. Фибриллогенез имеет важное значение в процессе приживления имплантанта и создания на его основе прочной, правильно функционирующей жевательной системы. Чем прочнее созданные в процессе фибриллогенеза коллагеновые волокна, тем прочнее соединительная ткань.
Структура

Молекула коллагена представляет собой левозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген[3]. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм.
Для первичной структуры белка характерно высокое содержание глицина, низкое содержание серосодержащих аминокислот и отсутствие триптофана. Коллаген относится к тем немногим белкам животного происхождения, которые содержат остатки нестандартных аминокислот: около 21 % от общего числа остатков приходится на 3-гидроксипролин, 4-гидроксипролин и 5-гидроксилизин[4]. Каждая из α-цепей состоит из триад аминокислот. В триадах третья аминокислота всегда глицин, вторая — пролин или лизин, первая — любая другая аминокислота, кроме трёх перечисленных[3].
Коллаген существует в нескольких формах. Основа строения всех видов коллагена является схожей. Коллагеновые волокна образуются путём агрегации микрофибрилл, имеют розовый цвет при окраске гематоксилином и эозином и голубой или зелёный при различных трёххромных окрасках, при импрегнации серебром окрашиваются в буро-жёлтый цвет.
Фибриллярная структура
Тропоколлагены (структурные единицы коллагена) спонтанно объединяются, прикрепляясь друг к другу смещёнными на определённое расстояние концами, образуя в межклеточном веществе более кру
Вся правда о коллагене от специалиста Colway
Красота
6 июня, 2019

Елена Сыркина, врач косметолог-дерматолог бренда Colway развеяла популярные мифы о коллагене и рассказала всю правду об этом веществе.
ФАКТ #1. Коллаген, который естественным образом вырабатывается кожей, и коллаген из продуктов на основе коллагена абсолютно идентичны.
Отчасти правда!
Тело человека почти наполовину (до 45%) состоит из коллагена. Этот белок служит строительным материалом для соединительных тканей (сухожилий, хрящей) и кожи, красота которой зависит от его содержания. Процесс синтеза коллагена наиболее интенсивен в детстве и молодости, а после 20-25 лет он начинает постепенно замедляться. Для того чтобы пополнять запасы этого важного вещества, недостаточно включать в рацион продукты с его содержанием.
В 60-х годах в Польской Народной Республике проводились научные исследования, в результате которых удалось получить коллаген из кожи рыб, обладающий свойствами живой ткани и сохраняющий их длительное время независимо от температурного воздействия. При этом структура и состав молекулы не отличаются от присущих натуральному коллагену, вырабатываемому организмом. За счет своих свойств этот коллаген способен после проникновения под кожу «встраиваться» в примыкающие ткани. Более того, присутствие молекул коллагена стимулирует и ускоряет естественный белковый синтез соединительных тканей и эпидермиса.
Однако существует большое количество продуктов якобы на основе коллагена, но по сути представляющих собой «мертвые» вещества. Пользы для кожи от них столько же, сколько от употребления холодца или желе. Поэтому не все средства с коллагеном эффективны.

ФАКТ #2. Молекулы коллагена настолько велики, что не могут проникнуть в глубокие слои кожи.
Отчасти правда!
Молекула коллагена имеет форму спирали. Ее длина – 300 нанометров (0,3 мкм), диаметр – 1,5 нм (0,015 мкм). Поры эпидермиса пропускают через себя вещества, меньшие 0,02 микрона. Получается, что столь крупная белковая структура, как коллаген, не способна проникнуть в глубокие ткани кожи.
Но особенность коллагена из кожи рыб в том, что он может распадаться на отдельные составляющие (цепочки аминокислот), преодолевать мембранный барьер кожи и вновь собираться в длинные спиралевидные молекулы, сразу же начиная свою работу. Этому также способствует текстура средств – у Colway в виде геля, температура – при соприкосновении с кожей подвижность молекул увеличивается и способ нанесения – в сочетании с легким массажем.
В 2007 году коллагеном Colway заинтересовалось Министерство обороны Российской Федерации. Проведенные исследования доказали эффективность средств в лечении ожогов и других последствий травм. Время выздоровления в среднем сокращается на 6 суток. Косвенно результаты этого отчета подтверждают и косметическую эффективность коллагена марки.

ФАКТ #3. Коллаген из питьевых добавок расщепляется в организме под воздействием ферментов и не приносит пользы коже. Для этого требуются уходовые средства на основе коллагена.
Правда!
На все вещества, поступающие в пищеварительный тракт, действуют расщепляющие их ферменты. Поэтому свои свойства «строительных кирпичиков» кожи коллаген утрачивает безвозвратно. Тем важнее принимать его наружно и на кожу.
ФАКТ #4. Коллаген подходит для любого типа кожи.
Правда!
Коллаген – это естественный регулятор состояния кожи, независимо от ее типа и возраста. Здоровая чистая дерма сама выбирает нужную «дозу» белка для самовосстановления. Кстати, стареющая кожа с морщинами становится уязвимой для бактерий. И важно, что, например, коллаген Colway помогает коже вырабатывать собственную защиту от попадания вредных микроорганизмов на нее, способствуя сужению пор и восстанавливая ее природную упругость.
ФАКТ #5. Растительный коллаген не существует.
Правда!
Во-первых, в растениях, действительно, нет коллагена. Во-вторых, производители, позиционирующие свои косметические средства как основанные на растительном белке, говорят о том, что в силу более низкой молекулярной массы их продукт хорошо проникает в кожу. Но выше мы уже выяснили, что молекула коллагена слишком велика. Если же размеры частиц меньше, значит, это не совсем коллаген. Вернее, совсем не коллаген.
Всего в настоящее время существует два типа белка, выделенного для косметических и лечебных целей – животного и рыбного происхождения. По эффективности, безусловно, лидирует последний.
ФАКТ #6. Весь коллаген, добавляемый в косметические средства, денатурированный, то есть биологически неактивный, а значит действует как плацебо.
Миф!
Большинство средств, на упаковках которых указано содержание коллагена, содержат денатурированный продукт. Это означает, что с целью обеспечения длительного срока хранения и использования в кремах и гелях присутствуют консерванты и стабилизаторы. Проще говоря, вещества, выдаваемые за коллаген, перестают проявлять свою биологическую активность и превращаются в желе, сходное по свойствам с обычным желатином. Отсюда предполагаемый эффект плацебо.
Но живой морской коллаген из кожи рыб за счет особой технологии производства и последующей очистки сверхтонкими мембранными фильтрами (для них применяется нить шелкопряда) сохраняет свою стабильность и, соответственно, свойства.
ФАКТ #7. Если после применения средств с морским коллагеном результатов нет, значит, он не работает.
Миф!
У коллагена есть враги. Препятствуют его воздействию вредные привычки и некоторые природные факторы. Они же, собственно, и старят кожу.
Во-первых, возраст. До 25 лет коллаген вырабатывается организмом в достаточном количестве, потом начинается спад его синтеза ежегодно на один процент. Поэтому, чем старше человек, тем нужнее ему морской коллаген, отличающийся высокой усвояемостью. Во-вторых, курение. Никотин и смолы, содержащиеся в табаке, разрушают ткани. Коллагена в организме и так в зрелом возрасте маловато, а если его целенаправленно уничтожать, то его станет еще меньше. В-третьих, алкоголь. Спирт разрушает белки, в том числе и коллаген.
Четвертый враг коллагена – излишне жирная пища. Она нарушает баланс обмена веществ и вызывает появление свободных радикалов, разрушающих ДНК.

Пятый враг коллагена – чрезмерно сладкие продукты. И в первую очередь следует отказаться от газированных напитков с огромным содержанием сахара. Они действуют «убойно» на коллаген и препятствуют его синтезу.
И, наконец, шестой неприятель – интенсивное ультрафиолетовое излучение. Страсть некоторых людей к загару приводит к нежелательному эффекту – преждевременному старению. Причина проста: солнечный свет «торпедирует» молекулы коллагена. Обожженная кожа выздоравливает медленно, и без последствий это не обходится.
Если ожидания от использования коллагена не оправдываются, нужно проанализировать воздействие факторов, вредоносных для кожи. Исключив их из своей жизни, можно повторить курс, и тогда эффект, безусловно, проявится.
Коллаген — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Коллаген — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у многоклеточных животных; отсутствует у растений, бактерий, вирусов, простейших и грибов[1]. Коллаген — основной компонент соединительной ткани и самый распространённый белок у млекопитающих[2], составляющий от 25 % до 35 % белков во всём теле.
История исследования
Учёные десятилетиями не могли понять молекулярное строение коллагена. Первое доказательство того, что коллаген имеет постоянное строение на молекулярном уровне, было представлено в середине 30-х годов прошлого века. С того времени много выдающихся учёных, включая Нобелевских лауреатов, таких как Фрэнсис Крик, Лайнус Полинг, Александр Рич, Ада Йонат, Хелен Берман, Вилеайнур Рамачандран работали над строением мономера коллагена.
Несколько противоречащих друг другу моделей (несмотря на известное строение каждой отдельной пептидной цепи) дали дорогу для создания троично-спиральной модели, объяснившей четвертичное строение молекулы коллагена.
Свойства
Продуктом денатурации коллагена является желатин. Температура денатурации макромолекулы коллагена близка к температуре фибриллогенеза. Это свойство молекулы коллагена делает её максимально чувствительной к мутационным заменам.
Структура
Молекула коллагена представляет собой правозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген[3]. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм.
Для первичной структуры белка характерно высокое содержание глицина, низкое содержание серосодержащих аминокислот и отсутствие триптофана. Коллаген относится к тем немногим белкам животного происхождения, которые содержат остатки нестандартных аминокислот: около 21 % от общего числа остатков приходится на 3-гидроксипролин, 4-гидроксипролин и 5-гидроксилизин[4]. Каждая из α-цепей состоит из триад аминокислот. В триадах третья аминокислота всегда глицин, вторая — пролин или лизин, первая — любая другая аминокислота, кроме трёх перечисленных[3].
Коллаген существует в нескольких формах. Основная строение всех видов коллагена является схожей. Коллагеновые волокна образуются путём агрегации микрофибрилл, имеют розовый цвет при окраске гематоксилином и эозином и голубой или зелёный при различных трёххромных окрасках, при импрегнации серебром окрашиваются в буро-жёлтый цвет.
Фибриллярная структура
Тропоколлагены (структурные единицы коллагена) спонтанно объединяются, прикрепляясь друг к другу смещенными на определённое расстояние концами, образуя в межклеточном веществе более крупные структуры. В фибриллярных коллагенах молекулы смещены относительно друг друга примерно на 67нм (единица, которая обозначается буквой «D» и меняется в зависимости от состояния гидратации вещества). В целом каждый D-период содержит четыре целых и часть пятой молекулы коллагена. Величина 300 нм, поделенная на 67 нм (300:67) не дают целого числа и длина молекулы коллагена разделена на непостоянные по величине отрезки D. Следовательно, в разрезе каждого повтора D-периода микрофибриллы есть часть, состоящая из пяти молекул, называемая «перекрытие», и часть, состоящая из четырёх молекул — «разрыв». Тропоколлагены к тому же скомпонованы в шестиугольную или псевдошестиугольную (в поперечном разрезе) конструкцию, в каждой области «перекрытия» и «разрыва».
Внутри тропоколлагенов существует ковалентная связь между цепями, а также некоторое непостоянное количество данных связей между самими тропоколагеновыми спиралями, образующими хорошо организованные структуры (например, фибриллы). Более толстые пучки фибрилл формируются с помощью белков нескольких других классов, включая другие типы коллагенов, гликопротеины, протеогликаны, использующихся для формирования различных типов тканей из разных комбинаций одних и тех же основных белков. Нерастворимость коллагена была препятствием к изучению мономера коллагена, до того момента как было обнаружено, что возможно извлечь тропоколлаген молодого животного, поскольку он ещё не образовал сильных связей с другими субъединицами фибриллы. Тем не менее, усовершенствование микроскопов и рентгеновских аппаратов облегчили исследования, появлялось все больше подробных изображений структуры молекулы коллагена. Эти поздние открытия очень важны для лучшего понимания того, как структура коллагена влияет на связи между клетками и межклеточным веществом, как ткани меняются во время роста и регенерации, как они меняются во время эмбрионального развития и при патологии.
Коллагеновая фибрилла — это полукристаллическая структурная единица коллагена. Коллагеновые волокна — это пучки фибрилл.
Использование
Пищевая промышленность
С точки зрения питания, коллаген и желатин являются белками низкого качества, так как они не содержат всех незаменимых аминокислот, необходимых человеку — это неполноценные белки. Производители основанных на коллагене пищевых добавок утверждают, что их продукты могут улучшить качество кожи и ногтей, а также здоровье суставовК:Википедия:Статьи без источников (тип: не указан)[источник не указан 3518 дней].
Относительно дешёвые, часто предлагаемые сегодня на рынке под видом источника свободных аминокислот гидролизаты коллагена не всегда способны удовлетворить потребности человека в свободных аминокислотах, так как эти продукты не содержат готовые к усвоению аминокислоты, а являются лишь частично «переваренными» экстрактами суставных тканей млекопитающих, птиц или обитателей моря. Например, гидролизаты коллагена почти полностью лишены аминокислоты L-глютамина, не отличающейся стойкостью к термическому воздействию и долгому хранению сырья, большая часть глютамина и разрушается уже на первых этапах хранения и переработки сырья, имеющийся небольшой остаток практически полностью распадается во время термической экстракции хрящевой ткани.
Наиболее качественными источниками аминокислот являются препараты, содержащие так называемые «свободные аминокислоты». Так как именно свободные аминокислоты являются практически готовыми к усвоению, организму принимающего человека не нужно тратить время, пищеварительные ферменты и энергию на их переваривание. Они способны в кратчайшие сроки поступить в кровь, и будучи доставленными ею к местам, нуждающимся в дополнительном синтезе коллагена, тут же включаются в его формированиеК:Википедия:Статьи без источников (тип: не указан)[источник не указан 3254 дня].
Косметические средства
Коллаген входит в состав косметических средств для :
- Образования воздухопроницаемого, влагоудерживающего слоя на поверхности кожи, обладающего пластифицирующими (разглаживающими) свойствами, со свойствами влажного компресса;
- Продления действия экстрактов, масел и др. в составе косметических композиций;
- Придания блеска волосам, создания коллагенового (защитного) слоя на поверхности волос.
Научные исследования
В 2005 году учёным удалось выделить коллаген из сохранившихся мягких тканей тираннозавра[5] и использовать его химический состав как ещё одно доказательство родства динозавров с современными птицами[6].
Научные исследования в медицине
Синтез коллагена — сложный ферментативный многостадийный процесс, который должен быть обеспечен достаточным количеством витаминов и минеральных элементов. Синтез протекает в фибробласте и ряд стадий вне фибробласта. Важный момент в синтезе — реакции гидроксилирования, которые открывают путь дальнейшим модификациям, необходимым для созревания коллагена. Катализируют реакции гидроксилирования специфические ферменты. Так, образование 4-оксипролина катализирует пролингидроксилаза, в активном центре которой находится железо. Фермент активен в том случае, если железо находится в двухвалентной форме, что обеспечивается аскорбиновой кислотой (витамин С). Дефицит аскорбиновой кислоты нарушает процесс гидроксилирования, что влияет на дальнейшие стадии синтеза коллагена: гликозилирование, отщепление N- и С-концевых пептидов и др. В результате синтезируется аномальный коллаген, более рыхлый. Эти изменения лежат в основе развития цинги. Коллаген и эластин формируют своеобразную «основу» кожи, которая предотвращает её обвисание, обеспечивает её эластичность и упругость. Эластин как белок прекращает выработку ферментов человека в 14 лет, а коллаген в 21—25, после чего кожные покровы не восстанавливаются и кожа стареет. Также важнейшим фибробластом является кератин — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога, перья и др.
Фотография
Белок является основой для фотографической желатины, которая вместе с микрокристаллами галогенидов серебра образует фотографическую эмульсию. При получении фотографической желатины коллаген денатурируют кислотой или щёлочью. Фотографическая эмульсия, нанесённая тонким слоем на целлулоидную плёнку, стекло или бумагу, а затем высушенная — это и есть светочувствительный слой фотоматериала (например, фотоплёнки).
Типы коллагена
В настоящее время описано 28 типов коллагена, которые кодируются более чем 40 генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации — интенсивности гидроксилирования или гликозилирования. Общим для всех коллагенов является существование 1 или более доменов, содержащих тройную спираль и присутствие их во внеклеточном матриксе. Более 90 % всего коллагена высших организмов приходится на коллагены I, II,III и IV типов.
| Разновидности коллагена | Типы |
|---|---|
| Фибриллярные коллагены | I, II, III, V, XI, XXIV, XXVII |
| Фибрилл-ассоциированные коллагены (FACIT) | IX, XII, XIV, XVI, XIX, XX, XXI, XXII |
| Коллагены, формирующие филаменты- бусины (beaded filament forming) | VI |
| Сетеобразующие коллагены | IV, VIII, X |
| Коллаген, формирующий якорные фибриллы | VII |
| Трансмембранные коллагены | XIII, XVII, XXIII, XXV/CLAC-P |
| Другие коллагены | XXVIII, XV, XVIII |
Кроме коллагеновых белков существует множество других белков, содержащих в своей структуре домен с тройной коллагеновой спиралью[7][8]. И, тем не менее, их не причисляют к коллагенам, а только к «коллагеноподобным». К большой группе коллагеноподобных белков относятся подкомпонент C1q-комплемента, C1q-подобный фактор, адипонектин, колектины и фиколины, концевая структура ацетилхолинестаразы, три макрофаговых рецептора, эктодисплазин и EMILIN. Эти белки, так же как и коллагены, играют структурную и регуляторную роль.
Коллаген первого типа, самый архетипичный, является тримерным белком, собирающимся в тройные спирали без разрывов, самособирающимся в фибриллы и обладающим наибольшей механической прочностью. Между тем, все остальные коллагены отличаются от него в одном или нескольких аспектах. Некоторые коллагены имеют разрывы в тройной спирали и не обязательно собираются в фибриллы.
| Тип коллагена | Гены | Молекулы | Органы | Ассоциированные болезни |
|---|---|---|---|---|
| I | COL1A1 COL1A2 | α1(I)2α2(I), α1(I)3 | Повсеместно в мягких и твёрдых тканях, в коже, костях, роговице глаза, в склере, в стенке артерий и др. | Синдром Элерса-Данлоса, остеогенез, ревматизм, синдром Марфана, дисплазии |
| II | COL2A1 | α1(II)3 + см тип XI | Гиалиновые и фиброзные хрящи, стекловидное тело, роговица | Коллагенопатия II и XI типа, синдром Стиклера, ахондрогенез |
| III | COL3A1 | α1(III)3 | Дерма кожи плода, стенки крупных кровеносных сосудов, ретикулярные волокна органов кроветворения | Синдром Элерса-Данлоса, фибромышечная дисплазия, аневризма аорты |
| IV | COL4A1 COL4A2 COL4A3 COL4A4 COL4A5 COL4A6 | α1(IV)2α2(IV), другие непонятно | Базальные мембраны, капсула хрусталика | Синдром Альпорта, синдроме Гудпасчера |
| V | COL5A1 COL5A2 COL5A3 | α1(V)2α2(V), α1(V)α2(V)α3(V) + см тип XI | Мягкие ткани, плацента, сосуды, хорион | Синдром Элерса-Данлоса |
| VI | COL6A1 COL6A2 COL6A3 COL6A4 COL6A5 COL6A6 | α1(VI)α2(VI)α3(VI) | Микрофибриллы в мягких тканях и хрящах | Миопатия Ульриха, миопатия Бэтлема, атопический дерматит |
| VII | COL7A1 | α1(VII)3 | Якорные фибриллы в связке кожи и эпидермиса | Буллезный эпидермолиз |
| VIII | COL8A1 COL8A2 | α1(VIII)α2(VIII) | Роговица, эндотелий | Дистрофия роговицы |
| IX | COL9A1 COL9A2 COL9A3 | α1(IX)α2(IX)α3(IX) | Хрящи, стекловидное тело | Синдром Стиклера, остеоартрит, эпифизарная дисплазия |
| X | COL10A1 | α1(X)3 | Гипертрофическая зона области роста | Метафизарная дисплазия Шмида |
| XI | COL11A1 COL11A2 | α1(XI)α2(XI)α1(II), α1(XI)α2(V)α1(II) | Хрящи, стекловидно тело | Коллагенопатия II и XI типов, остеопороз |
| XII | COL12A1 | α1(XII)3 | Мягкие ткани | Повреждения сухожилий |
| XIII | COL13A1 | α1(XIII)3 | Поверхность клеток, эпительные клетки | |
| XIV | COL14A1 | α1(IV)3 | Мягкие ткани | |
| XV | COL15A1 | α1(XV)3 | Эндотелиальные клетки | карцинома |
| XVI | COL16A1 | α1(XVI)3 | Повсеместно | |
| XVII | COL17A1 | α1(XVII)3 | Поверхность эпидермальных клеток | Буллезный эпидермиолиз, пузырчатка |
| XVIII | COL18A1 | α1(XVIII)3 | Эндотелиальные клетки | |
| XIX | COL19A1 | α1(XIX)3 | Повсеместно | Меланома, карцинома |
| XX | COL20A1 | α1(XX)3 | Выделен из куриного эмбриона | |
| XXI | COL21A1 | α1(XXI)3 | Кровеносные сосуды | |
| XXII | COL22A1 | α1(XXII)3 | Только в местах мышечно-сухожильных соединений | |
| XXIII | COL23A1 | α1(XXIII)3 | Опухолевые клетки | |
| XXIV | COL24A1 | α1(XXIV)3 | Формирующиеся кости | Остеохондроз |
| XXV | COL25A1 | α1(XXV)3 | Атеросклеротические бляшки | Болезнь Альцгеймера |
| XXVI | COL26A1=EMID2 | α1(XXVI)3 | Половые органы | |
| XXVII | COL27A1 | α1(XXVII)3 | Мягкие ткани | |
| XXVIII | COL28A1 | α1(XXVIII)3 | Нервная система |
Медицинские аспекты
Нарушения синтеза коллагена в организме лежат в основе таких наследственных заболеваний, как дерматоспораксис у животных, латиризм (характерна разболтанность суставов, привычные вывихи), синдром Элерса-Данлоса (до 14 типов проявлений), несовершенный остеогенез (болезнь «стеклянного человека», врождённый рахит, врождённая ломкость костей), болезнь Марфана.
Характерным проявлением этих заболеваний является повреждение связочного аппарата, хрящей, костной системы, наличие пороков сердечных клапанов.
Болезни, вызванные дефектами при биосинтезе коллагена, в том числе так называемые коллагенозы, возникают из-за множества причин. Это может быть из-за мутации в гене, кодирующем аминокислотную последовательность ферментов, продуцирующих коллаген, приводящей к изменению формы коллагеновой молекулы, или ошибки в посттранстляционной модификации коллагена. Также болезни могут быть вызваны недостатком или «неправильной работой» ферментов, вовлеченных в биосинтез коллагена — дефицит ферментов гидроксилирования (пролин-, лизингидроксилазы), гликозилтрансфераз, N-проколлагеновой и С-проколлагеновой пептидаз, лизилоксидаз с последующим нарушением поперечных сшивок, дефицит меди, витаминов В6, В13 (оротовая кислота), C. При приобретённых болезнях, таких как цинга, восстановление баланса ферментов до нормального может привести к полному излечению.
Практически любая генная мутация, ведёт к утрате или изменению функций коллагена, что, в свою очередь, отражается на свойствах тканей и органов. Генные мутации в коллагеновом домене могут привести к изменению формы тройной спирали, путём вставки/выпадения аминокислоты из полипептидной цепочки или замены Gly на другое основание. Мутации в неколлагеновых доменах могут привести к неправильной пространственной сборке α-цепей в надмолекулярные структуры (фибриллы или сети), что также ведёт к утрате функций. Мутантные α-цепи способны образовывать трёхспиральный комплекс с нормальными α-цепями. В большинстве случаев, такие комплексы нестабильны и быстро разрушаются, однако, такая молекула может и нормально выполнять свою роль, если не затронуты функционально важные области. Большинство болезней, вызванных мутациями в «коллагеновых» генах, являются доминантными.
Напишите отзыв о статье «Коллаген»
Примечания
- ↑ Fibrillar collagen: the key to vertebrate evolution? A tale of molecular incest. Boot-Handford RP, Tuckwell DS. Bioessays. 2003 Feb;25(2):142-51.
- ↑ Di Lullo, Gloria A. (2002). «Mapping the Ligand-binding Sites and Disease-associated Mutations on the Most Abundant Protein in the Human, Type I Collagen». J. Biol. Chem. 277 (6): 4223–4231. DOI:10.1074/jbc.M110709200. PMID 11704682.
- ↑ 1 2 [dic.academic.ru/dic.nsf/medic/7689 Тропоколлаген (Tropocollagen)] в словаре dic.academic.ru
- ↑ [www.xumuk.ru/encyklopedia/2062.html XuMuK.ru — КОЛЛАГЕН — Химическая энциклопедия]
- ↑ [news.bbc.co.uk/hi/russian/sci/tech/newsid_4382000/4382083.stm Би-би-си | Наука и техника | Найдены мягкие ткани тираннозавра?] — 25 марта 2005 г.
- ↑ [elementy.ru/news/430500 Элементы — новости науки: Коллаген из костей динозавров — это уже реальность]. — 20.04.07
- ↑ Franzke CW, Bruckner P, Bruckner-Tuderman L. Collagenous transmembrane proteins: recent insights into biology and pathology. J Biol Chem. 2005 Feb 11;280(6):4005-8.
- ↑ Hoppe HJ, Reid KB. Collectins—soluble proteins containing collagenous regions and lectin domains—and their roles in innate immunity. Protein Sci. 1994 Aug;3(8):1143-58
Ссылки
| ||||||||||||
Отрывок, характеризующий Коллаген
– Зачем мне, ваше сиятельство, воля? При покойном графе, царство небесное, жили и при вас обиды не видим.– Ну, а дети?
– И дети проживут, ваше сиятельство: за такими господами жить можно.
– Ну, а наследники мои? – сказал Пьер. – Вдруг я женюсь… Ведь может случиться, – прибавил он с невольной улыбкой.
– И осмеливаюсь доложить: хорошее дело, ваше сиятельство.
«Как он думает это легко, – подумал Пьер. – Он не знает, как это страшно, как опасно. Слишком рано или слишком поздно… Страшно!»
– Как же изволите приказать? Завтра изволите ехать? – спросил Савельич.
– Нет; я немножко отложу. Я тогда скажу. Ты меня извини за хлопоты, – сказал Пьер и, глядя на улыбку Савельича, подумал: «Как странно, однако, что он не знает, что теперь нет никакого Петербурга и что прежде всего надо, чтоб решилось то. Впрочем, он, верно, знает, но только притворяется. Поговорить с ним? Как он думает? – подумал Пьер. – Нет, после когда нибудь».
За завтраком Пьер сообщил княжне, что он был вчера у княжны Марьи и застал там, – можете себе представить кого? – Натали Ростову.
Княжна сделала вид, что она в этом известии не видит ничего более необыкновенного, как в том, что Пьер видел Анну Семеновну.
– Вы ее знаете? – спросил Пьер.
– Я видела княжну, – отвечала она. – Я слышала, что ее сватали за молодого Ростова. Это было бы очень хорошо для Ростовых; говорят, они совсем разорились.
– Нет, Ростову вы знаете?
– Слышала тогда только про эту историю. Очень жалко.
«Нет, она не понимает или притворяется, – подумал Пьер. – Лучше тоже не говорить ей».
Княжна также приготавливала провизию на дорогу Пьеру.
«Как они добры все, – думал Пьер, – что они теперь, когда уж наверное им это не может быть более интересно, занимаются всем этим. И все для меня; вот что удивительно».
В этот же день к Пьеру приехал полицеймейстер с предложением прислать доверенного в Грановитую палату для приема вещей, раздаваемых нынче владельцам.
«Вот и этот тоже, – думал Пьер, глядя в лицо полицеймейстера, – какой славный, красивый офицер и как добр! Теперь занимается такими пустяками. А еще говорят, что он не честен и пользуется. Какой вздор! А впрочем, отчего же ему и не пользоваться? Он так и воспитан. И все так делают. А такое приятное, доброе лицо, и улыбается, глядя на меня».
Пьер поехал обедать к княжне Марье.
Проезжая по улицам между пожарищами домов, он удивлялся красоте этих развалин. Печные трубы домов, отвалившиеся стены, живописно напоминая Рейн и Колизей, тянулись, скрывая друг друга, по обгорелым кварталам. Встречавшиеся извозчики и ездоки, плотники, рубившие срубы, торговки и лавочники, все с веселыми, сияющими лицами, взглядывали на Пьера и говорили как будто: «А, вот он! Посмотрим, что выйдет из этого».
При входе в дом княжны Марьи на Пьера нашло сомнение в справедливости того, что он был здесь вчера, виделся с Наташей и говорил с ней. «Может быть, это я выдумал. Может быть, я войду и никого не увижу». Но не успел он вступить в комнату, как уже во всем существе своем, по мгновенному лишению своей свободы, он почувствовал ее присутствие. Она была в том же черном платье с мягкими складками и так же причесана, как и вчера, но она была совсем другая. Если б она была такою вчера, когда он вошел в комнату, он бы не мог ни на мгновение не узнать ее.
Она была такою же, какою он знал ее почти ребенком и потом невестой князя Андрея. Веселый вопросительный блеск светился в ее глазах; на лице было ласковое и странно шаловливое выражение.
Пьер обедал и просидел бы весь вечер; но княжна Марья ехала ко всенощной, и Пьер уехал с ними вместе.
На другой день Пьер приехал рано, обедал и просидел весь вечер. Несмотря на то, что княжна Марья и Наташа были очевидно рады гостю; несмотря на то, что весь интерес жизни Пьера сосредоточивался теперь в этом доме, к вечеру они всё переговорили, и разговор переходил беспрестанно с одного ничтожного предмета на другой и часто прерывался. Пьер засиделся в этот вечер так поздно, что княжна Марья и Наташа переглядывались между собою, очевидно ожидая, скоро ли он уйдет. Пьер видел это и не мог уйти. Ему становилось тяжело, неловко, но он все сидел, потому что не мог подняться и уйти.
Княжна Марья, не предвидя этому конца, первая встала и, жалуясь на мигрень, стала прощаться.
– Так вы завтра едете в Петербург? – сказала ока.
– Нет, я не еду, – с удивлением и как будто обидясь, поспешно сказал Пьер. – Да нет, в Петербург? Завтра; только я не прощаюсь. Я заеду за комиссиями, – сказал он, стоя перед княжной Марьей, краснея и не уходя.
Наташа подала ему руку и вышла. Княжна Марья, напротив, вместо того чтобы уйти, опустилась в кресло и своим лучистым, глубоким взглядом строго и внимательно посмотрела на Пьера. Усталость, которую она очевидно выказывала перед этим, теперь совсем прошла. Она тяжело и продолжительно вздохнула, как будто приготавливаясь к длинному разговору.
Все смущение и неловкость Пьера, при удалении Наташи, мгновенно исчезли и заменились взволнованным оживлением. Он быстро придвинул кресло совсем близко к княжне Марье.
– Да, я и хотел сказать вам, – сказал он, отвечая, как на слова, на ее взгляд. – Княжна, помогите мне. Что мне делать? Могу я надеяться? Княжна, друг мой, выслушайте меня. Я все знаю. Я знаю, что я не стою ее; я знаю, что теперь невозможно говорить об этом. Но я хочу быть братом ей. Нет, я не хочу.. я не могу…
Он остановился и потер себе лицо и глаза руками.
– Ну, вот, – продолжал он, видимо сделав усилие над собой, чтобы говорить связно. – Я не знаю, с каких пор я люблю ее. Но я одну только ее, одну любил во всю мою жизнь и люблю так, что без нее не могу себе представить жизни. Просить руки ее теперь я не решаюсь; но мысль о том, что, может быть, она могла бы быть моею и что я упущу эту возможность… возможность… ужасна. Скажите, могу я надеяться? Скажите, что мне делать? Милая княжна, – сказал он, помолчав немного и тронув ее за руку, так как она не отвечала.
– Я думаю о том, что вы мне сказали, – отвечала княжна Марья. – Вот что я скажу вам. Вы правы, что теперь говорить ей об любви… – Княжна остановилась. Она хотела сказать: говорить ей о любви теперь невозможно; но она остановилась, потому что она третий день видела по вдруг переменившейся Наташе, что не только Наташа не оскорбилась бы, если б ей Пьер высказал свою любовь, но что она одного только этого и желала.
– Говорить ей теперь… нельзя, – все таки сказала княжна Марья.
– Но что же мне делать?
– Поручите это мне, – сказала княжна Марья. – Я знаю…
Пьер смотрел в глаза княжне Марье.
– Ну, ну… – говорил он.
– Я знаю, что она любит… полюбит вас, – поправилась княжна Марья.
Не успела она сказать эти слова, как Пьер вскочил и с испуганным лицом схватил за руку княжну Марью.
– Отчего вы думаете? Вы думаете, что я могу надеяться? Вы думаете?!
– Да, думаю, – улыбаясь, сказала княжна Марья. – Напишите родителям. И поручите мне. Я скажу ей, когда будет можно. Я желаю этого. И сердце мое чувствует, что это будет.
– Нет, это не может быть! Как я счастлив! Но это не может быть… Как я счастлив! Нет, не может быть! – говорил Пьер, целуя руки княжны Марьи.
– Вы поезжайте в Петербург; это лучше. А я напишу вам, – сказала она.
– В Петербург? Ехать? Хорошо, да, ехать. Но завтра я могу приехать к вам?
На другой день Пьер приехал проститься. Наташа была менее оживлена, чем в прежние дни; но в этот день, иногда взглянув ей в глаза, Пьер чувствовал, что он исчезает, что ни его, ни ее нет больше, а есть одно чувство счастья. «Неужели? Нет, не может быть», – говорил он себе при каждом ее взгляде, жесте, слове, наполнявших его душу радостью.
Когда он, прощаясь с нею, взял ее тонкую, худую руку, он невольно несколько дольше удержал ее в своей.
«Неужели эта рука, это лицо, эти глаза, все это чуждое мне сокровище женской прелести, неужели это все будет вечно мое, привычное, такое же, каким я сам для себя? Нет, это невозможно!..»
– Прощайте, граф, – сказала она ему громко. – Я очень буду ждать вас, – прибавила она шепотом.
И эти простые слова, взгляд и выражение лица, сопровождавшие их, в продолжение двух месяцев составляли предмет неистощимых воспоминаний, объяснений и счастливых мечтаний Пьера. «Я очень буду ждать вас… Да, да, как она сказала? Да, я очень буду ждать вас. Ах, как я счастлив! Что ж это такое, как я счастлив!» – говорил себе Пьер.
В душе Пьера теперь не происходило ничего подобного тому, что происходило в ней в подобных же обстоятельствах во время его сватовства с Элен.
Он не повторял, как тогда, с болезненным стыдом слов, сказанных им, не говорил себе: «Ах, зачем я не сказал этого, и зачем, зачем я сказал тогда „je vous aime“?» [я люблю вас] Теперь, напротив, каждое слово ее, свое он повторял в своем воображении со всеми подробностями лица, улыбки и ничего не хотел ни убавить, ни прибавить: хотел только повторять. Сомнений в том, хорошо ли, или дурно то, что он предпринял, – теперь не было и тени. Одно только страшное сомнение иногда приходило ему в голову. Не во сне ли все это? Не ошиблась ли княжна Марья? Не слишком ли я горд и самонадеян? Я верю; а вдруг, что и должно случиться, княжна Марья скажет ей, а она улыбнется и ответит: «Как странно! Он, верно, ошибся. Разве он не знает, что он человек, просто человек, а я?.. Я совсем другое, высшее».
Только это сомнение часто приходило Пьеру. Планов он тоже не делал теперь никаких. Ему казалось так невероятно предстоящее счастье, что стоило этому совершиться, и уж дальше ничего не могло быть. Все кончалось.
Радостное, неожиданное сумасшествие, к которому Пьер считал себя неспособным, овладело им. Весь смысл жизни, не для него одного, но для всего мира, казался ему заключающимся только в его любви и в возможности ее любви к нему. Иногда все люди казались ему занятыми только одним – его будущим счастьем. Ему казалось иногда, что все они радуются так же, как и он сам, и только стараются скрыть эту радость, притворяясь занятыми другими интересами. В каждом слове и движении он видел намеки на свое счастие. Он часто удивлял людей, встречавшихся с ним, своими значительными, выражавшими тайное согласие, счастливыми взглядами и улыбками. Но когда он понимал, что люди могли не знать про его счастье, он от всей души жалел их и испытывал желание как нибудь объяснить им, что все то, чем они заняты, есть совершенный вздор и пустяки, не стоящие внимания.
Когда ему предлагали служить или когда обсуждали какие нибудь общие, государственные дела и войну, предполагая, что от такого или такого исхода такого то события зависит счастие всех людей, он слушал с кроткой соболезнующею улыбкой и удивлял говоривших с ним людей своими странными замечаниями. Но как те люди, которые казались Пьеру понимающими настоящий смысл жизни, то есть его чувство, так и те несчастные, которые, очевидно, не понимали этого, – все люди в этот период времени представлялись ему в таком ярком свете сиявшего в нем чувства, что без малейшего усилия, он сразу, встречаясь с каким бы то ни было человеком, видел в нем все, что было хорошего и достойного любви.
Рассматривая дела и бумаги своей покойной жены, он к ее памяти не испытывал никакого чувства, кроме жалости в том, что она не знала того счастья, которое он знал теперь. Князь Василий, особенно гордый теперь получением нового места и звезды, представлялся ему трогательным, добрым и жалким стариком.
Пьер часто потом вспоминал это время счастливого безумия. Все суждения, которые он составил себе о людях и обстоятельствах за этот период времени, остались для него навсегда верными. Он не только не отрекался впоследствии от этих взглядов на людей и вещи, но, напротив, в внутренних сомнениях и противуречиях прибегал к тому взгляду, который он имел в это время безумия, и взгляд этот всегда оказывался верен.
«Может быть, – думал он, – я и казался тогда странен и смешон; но я тогда не был так безумен, как казалось. Напротив, я был тогда умнее и проницательнее, чем когда либо, и понимал все, что стоит понимать в жизни, потому что… я был счастлив».
Безумие Пьера состояло в том, что он не дожидался, как прежде, личных причин, которые он называл достоинствами людей, для того чтобы любить их, а любовь переполняла его сердце, и он, беспричинно любя людей, находил несомненные причины, за которые стоило любить их.
С первого того вечера, когда Наташа, после отъезда Пьера, с радостно насмешливой улыбкой сказала княжне Марье, что он точно, ну точно из бани, и сюртучок, и стриженый, с этой минуты что то скрытое и самой ей неизвестное, но непреодолимое проснулось в душе Наташи.
Все: лицо, походка, взгляд, голос – все вдруг изменилось в ней. Неожиданные для нее самой – сила жизни, надежды на счастье всплыли наружу и требовали удовлетворения. С первого вечера Наташа как будто забыла все то, что с ней было. Она с тех пор ни разу не пожаловалась на свое положение, ни одного слова не сказала о прошедшем и не боялась уже делать веселые планы на будущее. Она мало говорила о Пьере, но когда княжна Марья упоминала о нем, давно потухший блеск зажигался в ее глазах и губы морщились странной улыбкой.
Перемена, происшедшая в Наташе, сначала удивила княжну Марью; но когда она поняла ее значение, то перемена эта огорчила ее. «Неужели она так мало любила брата, что так скоро могла забыть его», – думала княжна Марья, когда она одна обдумывала происшедшую перемену. Но когда она была с Наташей, то не сердилась на нее и не упрекала ее. Проснувшаяся сила жизни, охватившая Наташу, была, очевидно, так неудержима, так неожиданна для нее самой, что княжна Марья в присутствии Наташи чувствовала, что она не имела права упрекать ее даже в душе своей.
Наташа с такой полнотой и искренностью вся отдалась новому чувству, что и не пыталась скрывать, что ей было теперь не горестно, а радостно и весело.
Когда, после ночного объяснения с Пьером, княжна Марья вернулась в свою комнату, Наташа встретила ее на пороге.
– Он сказал? Да? Он сказал? – повторила она. И радостное и вместе жалкое, просящее прощения за свою радость, выражение остановилось на лице Наташи.
– Я хотела слушать у двери; но я знала, что ты скажешь мне.
Как ни понятен, как ни трогателен был для княжны Марьи тот взгляд, которым смотрела на нее Наташа; как ни жалко ей было видеть ее волнение; но слова Наташи в первую минуту оскорбили княжну Марью. Она вспомнила о брате, о его любви.
«Но что же делать! она не может иначе», – подумала княжна Марья; и с грустным и несколько строгим лицом передала она Наташе все, что сказал ей Пьер. Услыхав, что он собирается в Петербург, Наташа изумилась.
– В Петербург? – повторила она, как бы не понимая. Но, вглядевшись в грустное выражение лица княжны Марьи, она догадалась о причине ее грусти и вдруг заплакала. – Мари, – сказала она, – научи, что мне делать. Я боюсь быть дурной. Что ты скажешь, то я буду делать; научи меня…
– Ты любишь его?
– Да, – прошептала Наташа.
– О чем же ты плачешь? Я счастлива за тебя, – сказала княжна Марья, за эти слезы простив уже совершенно радость Наташи.
– Это будет не скоро, когда нибудь. Ты подумай, какое счастие, когда я буду его женой, а ты выйдешь за Nicolas.
– Наташа, я тебя просила не говорить об этом. Будем говорить о тебе.
Они помолчали.
– Только для чего же в Петербург! – вдруг сказала Наташа, и сама же поспешно ответила себе: – Нет, нет, это так надо… Да, Мари? Так надо…
Прошло семь лет после 12 го года. Взволнованное историческое море Европы улеглось в свои берега. Оно казалось затихшим; но таинственные силы, двигающие человечество (таинственные потому, что законы, определяющие их движение, неизвестны нам), продолжали свое действие.
Несмотря на то, что поверхность исторического моря казалась неподвижною, так же непрерывно, как движение времени, двигалось человечество. Слагались, разлагались различные группы людских сцеплений; подготовлялись причины образования и разложения государств, перемещений народов.
Историческое море, не как прежде, направлялось порывами от одного берега к другому: оно бурлило в глубине. Исторические лица, не как прежде, носились волнами от одного берега к другому; теперь они, казалось, кружились на одном месте. Исторические лица, прежде во главе войск отражавшие приказаниями войн, походов, сражений движение масс, теперь отражали бурлившее движение политическими и дипломатическими соображениями, законами, трактатами…
Эту деятельность исторических лиц историки называют реакцией.
Описывая деятельность этих исторических лиц, бывших, по их мнению, причиною того, что они называют реакцией, историки строго осуждают их. Все известные люди того времени, от Александра и Наполеона до m me Stael, Фотия, Шеллинга, Фихте, Шатобриана и проч., проходят перед их строгим судом и оправдываются или осуждаются, смотря по тому, содействовали ли они прогрессу или реакции.
«Чем отличаются коллаген и гликоген по строению?» – Яндекс.Знатоки
Коллаген – это белок, а гликоген – полисахарид.
Коллаген представляет собой фибриллярный, вытянутый, белок, каждая молекула представляет собой левозакрученную спираль из трёх переплетающихся полипептидных цепочек. В цепочках много гидроксилированных аминокислот, благодаря которым цепочки взаимодействуют между собой. Витамин C нужен, в первую очередь, для гидроксилирования аминокислот, недостаток витамина C ведёт к проблемам с соединительной тканью, в частности, к цинге. Каждая третья аминокислота в цепочках спирали – глицин, у которого боковая группа представлена лишь одним протоном. Глицин обеспечивает компактность структуры молекулы коллагена. В реальном коллагене тройные спирали располагаются строго определённым образом относительно друг друга, образуя структуры более высокого порядка – фибриллы, обладающие свойством механической прочности. В частности, это позволяет костям не ломаться и выполнять опорную функцию. Вообще говоря, коллаген – самый распространённый белок млекопитающих, он составляет порядка четверти всей нашей белковой массы. Известно около 30 классов коллагена, которые распределены по разным тканям.
Гликоген – это не белок, а полисахарид, а именно полимер глюкозы. Главная его функция – запасающая (глюкоза – источник энергии). В структуре молекулы гликогена можно увидеть, что линейные области цепочки иногда прерываются развилками. Это обеспечивается специальным ферментом, который действует на стадии образования этого полисахарида. Гликоген у нас есть в печени и мышцах. Правда, запасов печёночного гликогена хватает примерно на один день, эти резервы надо постоянно пополнять.

