Онкологические заболевания что это – Что такое онкология, какие онкологические заболевания существуют, и как их предупредить?
«Что такое онкология?» – Яндекс.Кью
Онкология – раздел медицины, изучающий опухоли (в первую очередь — злокачественные), их биологию и развитие, а также методы диагностики и лечения. В немедицинской среде онкологией называют всю категорию злокачественных новообразований.
Злокачественные опухоли — большая и разнородная группа заболеваний: “рак” (опухоли из эпителиальной ткани), саркомы (опухоли из соединительных тканей), лимфомы (опухоли из клеток кроветворной и иммунной системы) и др.
Онкологические заболевания — большая медицинская и социальная проблема, т. к. смертность от них очень высока. Это связано с агрессивным течением многих злокачественных опухолей (в особенности — раковых опухолей и сарком в поздних стадиях) и отсутствием в большинстве случаев радикальных методов лечения. Еще одной большой проблемой является отсутствие или слабое развитие в некоторых странах системы скрининга — выявления опухоли на ранних стадиях, когда симптомов болезни еще нет. Конечная цель скрининга — снижение смертности.
Онкология — крупная и значимая отрасль медицины. В клинической практике врачи-онкологи делятся на онкологов-хирургов, специалистов по лекарственной терапии (химиотерапевтов) и лучевых терапевтов. Из-за сложного течения большинства онкологических заболеваний в лечении пациентов участвует множество других специалистов (терапевты, общие хирурги, реаниматологи и др.). Онкологическую помощь больные получают, как правило, в онкодиспансерах или специализированных онкологических центрах, в которых обычно присутствуют три основных направления: хирургия, химиотерапия и радиология.
Онкология — не только область клинической медицины, но и самостоятельное научное направление. Вопросами фундаментальной онкологии — выяснением механизмов развитие опухоли, доклиническими исследованиями и т. д. — занимаются ученые смежных специальностей: генетики, молекулярные биологи и биохимики.
Если у вас есть вопросы об онкологической помощи для вас или ваших близких, вы можете обратиться в сервис “Просто спросить”.
Рак лёгкого — Википедия
Рак лёгкого (бронхогенный рак, бронхогенная карцинома, разг. рак легких) — злокачественное новообразование лёгкого, происходящее из эпителиальной ткани бронхов различного калибра. В зависимости от места появления подразделяется на центральный, периферический и массивный (смешанный).
Рак лёгкого является серьёзной медицинской и социальной проблемой, в развитых странах он является наиболее часто встречающейся злокачественной опухолью и является наиболее распространённой причиной смерти от онкологической патологии. Согласно данным международного агентства по изучению рака, ежегодно в мире регистрируется около 1 миллиона новых случаев рака лёгкого, и 60 % онкологических больных погибает в результате данного заболевания.[2]
В России рак лёгкого также занимает 1 место среди онкологических заболеваний и его доля в данной патологии составляет 12 %, в 15 % случаев у умерших онкобольных был выставлен диагноз рак лёгкого. Мужчины болеют раком лёгкого значительно чаще, каждая 4-я злокачественная опухоль у мужчин является раком лёгкого, у женщин же — только каждая 12-я. По данным 2000 года рак лёгкого стал причиной смерти 32 % мужчин, и 7,2 % женщин, у которых были обнаружены какие-либо злокачественные новообразования.
 Плоскоклеточный центральный рак лёгкого
Плоскоклеточный центральный рак лёгкогоК основным причинам любого рака относят канцерогены (например, табачного дыма), ионизирующее излучение и вирусную инфекцию. Их воздействие вызывает кумулятивные изменения ДНК в выстилающей ткани бронхов лёгкого (бронхиальном эпителии). Чем больше тканей повреждено, тем выше риск развития рака
Курение табака[править | править код]
Курение табака на сегодняшний день — основная причина рака лёгкого[4]. По сравнению с некурящими, у курильщиков риск развития рака лёгких выше примерно в 20 раз[5]. Сигаретный дым содержит более 60 известных канцерогенов,[6] в том числе радиоизотопы радона, нитрозамин и бензпирен. Кроме того, полагают, что никотин подавляет иммунную систему, что способствует озлокачествлению тканей[7]. В развитых странах почти 90 % случаев смертельного рака лёгкого вызваны курением[8]. Среди курящих мужчин пожизненный риск развития рака лёгкого составляет 17,2 %, среди курящих женщин — 11,6 %. Этот риск значительно ниже у некурящих: 1,3 % у мужчин и 1,4 % у женщин
Женщины, которые курят и получают гормональную терапию, имеют гораздо более высокий риск смерти от рака лёгкого. В исследовании, проведённом в 2009 году, было показано, что женщины, принимающие гормоны, имеют на 60 % выше вероятность смерти от рака лёгкого, чем женщины, принимающие плацебо. Среди женщин, которые курили (бывшие и нынешние курильщицы), 3,4 % из них, кто принимал гормоны умерло от рака лёгкого по сравнению с 2,3 % женщин, принимавших плацебо[10].
Со стажем курения табака увеличивается вероятность развития рака лёгкого у человека. Если человек прекращает курить, эта вероятность неуклонно уменьшается, так как повреждённые лёгкие восстанавливаются, и загрязняющие частицы постепенно удаляются
Пассивное курение (вдыхание дыма табака от другого курильщика) — одна из причин рака лёгкого у некурильщиков. Исследования в США[14], Европе[15], Великобритании[16], и Австралии[17] показали значительное увеличение относительного риска среди тех, кто подвергается пассивному курению. Последние исследования показали, что выдыхаемый курильщиком дым более опасен, чем вдыхание его прямо из сигареты
Радон[править | править код]
Радон — газ без цвета и запаха, образующийся при распаде радиоактивного радия, который в свою очередь является продуктом распада урана, присутствующего в коре Земли. Радиоактивное излучение способно повреждать генетический материал, вызывая мутации, которые иногда приводят к возникновению злокачественных опухолей. Воздействие радона — вторая причина рака лёгкого в общей популяции, после курения[20] с увеличением риска от 8 % до 16 % на каждые 100 Бк/м³ увеличения концентрации радона
Асбестоз[править | править код]
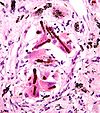
Асбест может вызывать различные лёгочные заболевания, включая рак лёгкого. Существует взаимоусиливающий эффект курения табака и асбестоза в возникновении рака лёгкого[22]. Асбестоз также может вызывать рак плевры, называемый мезотелиома (который следует дифференцировать от рака лёгкого).
Вирусы[править | править код]
Вирусы известны способностью вызывать рак лёгкого у животных[23][24], и последние данные свидетельствуют о способности его вызывать у человека. К таким вирусам относят вирус папилломы человека[25], JC вирус[26], обезьяний вирус 40 (SV40), BK вирус и цитомегаловирус[27]. Эти вирусы могут влиять на клеточный цикл и подавлять апоптоз, способствуя неконтролируемому делению клеток.
Пылевые частицы[править | править код]
Исследования Американского общества рака выявили прямую связь воздействия пылевых частиц с раком лёгкого. Например, если концентрация пыли в воздухе увеличивается только на 1 %, риск развития рака лёгкого возрастает на 14 %
Классификация рака лёгкого по стадиям[править | править код]
Согласно отечественной классификации, рак лёгкого подразделяется на следующие стадии:
- I стадия — опухоль до 3 см в наибольшем измерении, расположена в одном сегменте лёгкого или в пределах сегментарного бронха. Метастазов нет.
- II стадия — опухоль до 6 см в наибольшем измерении, расположена в одном сегменте лёгкого или в пределах сегментарного бронха. Наблюдаются единичные метастазы в пульмональных и бронхопульмональных лимфатических узлах.
- IV стадия — опухоль выходит за пределы лёгкого с распространением на соседние органы и обширными местными и отдалёнными метастазами, присоединяется плеврит и/или перикардит.
Согласно TNМ-классификации, опухоли определяют:
T — первичная опухоль:
- Тх — недостаточно данных для оценки первичной опухоли либо опухолевые клетки обнаружены только в мокроте или промывных водах бронхов, но не выявлена бронхоскопией и/или другими методами
- Т0 — первичная опухоль не определяется
- Тis — неинвазивный рак (carcinoma in situ)
- Tl — опухоль до 3 см в наибольшем измерении, окружённая лёгочной тканью или висцеральной плеврой без прорастания проксимальнее долевого бронха при бронхоскопии (главный бронх не поражён)
- Т2 — опухоль более 3 см в наибольшем измерении или опухоль любого размера, прорастающая висцеральную плевру, или сопровождающаяся ателектазом, или обструктивной пневмонией, распространяющаяся на корень лёгкого, но не захватывающая всё лёгкое; По данным бронхоскопии, проксимальный край опухоли располагается не менее 2 см от карины.
- ТЗ — опухоль любого размера, переходящая на грудную стенку (в том числе опухоль верхней борозды), диафрагму, медиастинальную плевру, перикард; опухоль, не доходящая до карины менее чем на 2 см, но без вовлечения карины, или опухоль с сопутствующим ателектазом или обструктивной пневмонией всего лёгкого.
- Т4 — опухоль любого размера непосредственно переходящая на средостение, сердце, крупные сосуды, трахею, пищевод, тела позвонков, карину (отдельные опухолевые узлы в той же доле или опухоль со злокачественным плевральным выпотом)
N — регионарные лимфатические узлы
- Nx — недостаточно данных для оценки состояния регионарных лимфатических узлов
- N0 — нет признаков метастатического поражения регионарных лимфатических узлов
- N1 — имеется поражение перибронхиальных и/или лимфатических узлов корня лёгкого на стороне поражения, включая непосредственное распространение опухоли на лимфатические узлы.
- N2 — имеется поражение лимфатических узлов средостения на стороне поражения или бифуркационных лимфатических узлов.
- N3 — поражение лимфатических узлов средостения или корня лёгкого на противоположной стороне: прескаленных или надключичных узлов на стороне поражения или на противоположной стороне
М — отдалённые метастазы
- Мх — недостаточно данных для определения отдалённых метастазов
- М0 — нет признаков отдалённых метастазов
- M1 — имеются признаки отдалённых метастазов, включая отдельные опухолевые узлы в другой доле
- М1а — интраторакальные метастазы, отдельные опухолевые узлы в контралатеральном, противоположном лёгком. Опухоль большого размера, но локализованная в органах грудной полости.
- М1в — экстраторакальные метастазы, метастатические опухоли за пределами грудной полости- в головном мозгу, печени, костях, почках, надпочечниках.
G — гистопатологическая градация
- Gx — степень дифференцировки клеток не может быть оценена
- G1 — высокая степень дифференцировки
- G2 — умеренная степень дифференцировки
- G3 — низкодифференцированная опухоль
- G4 — недифференцированная опухоль
Гистологическая классификация рака лёгкого[править | править код]
| Гистологический тип | Частота (в %) |
|---|---|
| Немелкоклеточный рак лёгкого | 80.4 |
| Мелкоклеточный рак лёгкого | 16.8 |
| Карциноид[32] | 0.8 |
| Саркома[33] | 0.1 |
| Неуточнённая злокачественная опухоль лёгкого | 1.9 |
Согласно гистологической классификации рак лёгкого подразделяется на следующие виды:
I. Плоскоклеточный (эпидермоидный) рак
- а) высокодифференцированный
- б) умеренно дифференцированный
- в) малодифференцированный
II. Мелкоклеточный рак
- а) овсяноклеточный, веретёноклеточный
- б) плеоморфный
III. Аденокарцинома
- а) высокодифференцированная
- б) умеренно-дифференцированная
- в) малодифференцированная
- г) бронхоальвеолярная
IV. Крупноклеточный рак
- а) гигантоклеточный
- б) светлоклеточный
V. Смешанный рак
- плоскоклеточный и аденокарцинома
- аденокарцинома и мелкоклеточный и т. д.
Гистологическая характеристика рака лёгкого достаточно условна, поскольку клиническое течение может сильно различаться даже для опухолей с одинаковой структурой. Медленнее всего растёт дифференцированный плоскоклеточный рак; для недифференцированного рака характерно быстрое течение с обширным метастазированием. Мелкоклеточный рак лёгкого принадлежит к числу самых злокачественных опухолей. Он отличается коротким анамнезом, скрытым и быстрым протеканием, ранним метастазированием, плохим прогнозом.
Рак лёгкого метастазирует тремя путями: лимфогенным, гематогенным и имплантационным.
Наиболее характерен первый путь — в расположенные рядом пульмональные, бронхопульмональные, бифуркационные, трахеобронхиальные, паратрахеальные, околопищеводные (параэзофагеальные) лимфатические узлы. На первом этапе лимфогенного метастазирования поражаются лёгочные лимфатические узлы у места деления долевого бронха на сегментарные. Далее процесс распространяется на бронхопульмональные лимфоузлы вдоль долевых бронхов. На третьем этапе метастазы возникают в корневых лимфоузлах вдоль главного бронха и сосудов корня лёгкого, верхних и нижних трахеобронхиальных лимфоузлах и лимфоузлах у нижней стенки непарной вены. На четвёртом этапе в процесс вовлекаются паратрахеальные, ретрокавальные, предаортокаротидные, перикардиальные, параэзофагеальные лимфоузлы. На пятом — над/подключичные лимфатические узлы.
Гематогенное метастазирование присоединяется при прорастании опухолью кровеносных сосудов — в печень, лёгкие, почки, кость, головной мозг и надпочечники.
При прорастании плевры возможен перенос опухолевых клеток по плевре.
Клинические проявления рака лёгкого существенно зависят от локализации первичного опухолевого узла.
Центральный рак лёгкого. Опухоль, происходящая из слизистой оболочки крупного бронха, проявляет себя довольно рано. При своём росте она раздражает слизистую оболочку бронха, вызывает нарушение бронхиальной проходимости и вентиляции сегмента, доли или всего лёгкого в виде гиповентиляции и ателектаза. В дальнейшем прорастая нервные стволы и плевру, опухоль вызывает болевой синдром и нарушение иннервации соответствующего нерва (диафрагмального, возвратного или блуждающего), а также картину вовлечения плевры в опухолевый процесс. Присоединяющееся метастазирование приводит к появлению вторичных симптомов со стороны поражённых органов и систем.
Когда опухоль прорастает в бронх, появляется кашель, вначале сухой, затем со светлой мокротой, иногда с примесью крови. Возникает гиповентиляция сегмента лёгкого и затем его ателектаз. Мокрота становится гнойной, что сопровождается повышением температуры тела, общим недомоганием, одышкой. Присоединяется раковая пневмония, которая сравнительно легко излечивается, но часто рецидивирует. К раковой пневмонии может присоединиться раковый плеврит, сопровождающийся болевым синдромом.
Если опухоль прорастает возвратный нерв, присоединяется осиплость ввиду паралича голосовых мышц. Поражение диафрагмального нерва вызывает паралич диафрагмы. Прорастание перикарда проявляется болями в области сердца.
Поражение опухолью или её метастазами верхней полой вены вызывает нарушение оттока крови и лимфы из верхней половины туловища, верхних конечностей, головы и шеи. Лицо больного становится одутловатым, с цианотичным оттенком, набухают вены на шее, руках, грудной клетке.
Периферический рак лёгкого. Периферическая опухоль в начальной стадии протекает бессимптомно ввиду отсутствия болевых окончаний в лёгочной ткани. В дальнейшем опухолевый узел увеличивается, прорастает бронхи, плевру и соседние органы; впоследствии в центре опухоли могут возникнуть распад и кровотечение.
При раке лёгкого могут наблюдаться следующие местные симптомы: кашель, выделение крови с мокротой, осиплость голоса, синдром сдавливания опухолью верхней полой вены и смещения средостения, симптомы прорастания опухолью соседних органов. Особенно характерной клинической картиной, в связи с локализацией, проявляется рак верхушки лёгкого с синдромом Панкоста.
При раковом плеврите присоединяется синдром сдавливания лёгкого экссудатом.
К общим симптомам относятся общее ухудшение состояния организма, характерное для развития злокачественных опухолей: интоксикация, одышка, слабость, потеря веса, повышение температуры тела. Для рака лёгкого добавляются также нарушение обмена кальция, дерматит и деформация пальцев по типу «барабанных палочек».
В запущенных стадиях присоединяются симптомы метастатического поражения жизненно важных органов, а также присоединяющиеся к опухолевому росту процессы распада опухоли и лёгочной ткани, бронхиальной непроходимости, ателектазы, тяжёлые лёгочные кровотечения.
Клиническое обследование[править | править код]
При клиническом обследовании определяют внешнюю симптоматику развития рака лёгкого:
- Первичные ранние симптомы (кашель, кровохарканье, одышка и боль в груди)
- Вторичные, более поздние симптомы, обусловленные осложнениями при развитии опухоли (воспалительные процессы, прорастание соседних органов, метастазы)
- Общие симптомы, характерные для влияния злокачественных опухолей на организм (общая слабость, утомляемость, снижение работоспособности и т. д.)
Рентгенологическая диагностика[править | править код]
Рентгенологическое исследование является одним из основных методов диагностики опухолей лёгкого и позволяет своевременно обнаружить его у 80 % больных. В качестве скринингового метода используется флюорография, которая обычно проводится во время профилактических медосмотров. При выявлении изменений (солитарный лёгочный узел, ателектаз и т. д.) на флюорограмме или при наличии клинических показаний применяют рентгенографию в двух проекциях и компьютерную томографию. Кроме того, компьютерная томография является наиболее информативным методом диагностики метастазов в других органах.
Бронхоскопия[править | править код]
Бронхоскопия позволяет визуально исследовать трахею, главные, долевые, сегментарные, субсегментарные бронхи и, в некоторых случаях, бронхи 6-го, 7-го и более порядков. При этом можно непосредственно увидеть опухоль и осуществить её биопсию. Бронхоскопия считается обязательной при подозрении на рак лёгкого.
Трансторакальная биопсия[править | править код]
Трансторакальная пункционная биопсия применяется при невозможности проведения других методов (бронхоскопия, катетеризация бронхов, анализ мокроты). Показаниями к её проведению являются:
- округлое образование в любой зоне лёгкого
- подозрение на метастаз в лёгком опухоли с другой локализацией
- множественные внутрилёгочные шаровидные тени
При трансторакальной пункции проводят прокол грудной клетки, отбирают пробу непосредственно из опухоли и исследуют клетки под микроскопом. Такой метод диагностики позволяет подтвердить диагноз у значительного числа больных (62-87 % случаев в зависимости от локализации опухоли). Наиболее частым осложнением (до 50 %) данной процедуры является закрытый пневмоторакс, требующий дренирования плевральной полости.
Ультразвуковая диагностика[править | править код]
Ультразвуковое исследование является эффективным методом выявления врастания злокачественной опухоли в структуры стенки, масштабного затемнения лёгочной ткани (из-за её уплотнения, плеврального выпота и др.), а через ткань безвоздушного лёгкого получается увидеть непосредственно опухолевый узел.
Такая диагностика является безопасной, простой и сравнительно недорогой. Она позволяет определить опухолевое поражение органов средостения: верхней полой вены, перикарда и камер сердца, правой и левой лёгочных артерий, лёгочных вен, аорты, пищевода, левого предсердия, а также степень применимости хирургического лечения опухоли.
Опухолевые маркеры[править | править код]
Изученные на текущий момент маркеры рака лёгкого не показывают достоверной специфичности. Прогностическое значение многих из них спорно и, главным образом, отражает различия в методологии исследований, группах пациентов и интерпретациях. Для мелкоклеточного рака лёгкого предпочтительным опухолевым маркёром является нейрон-специфическая энолаза (NSE), для немелкоклеточных вариантов неоплазий специфического маркёра не найдено.
Маркёры лёгочных карцином делятся на 2 группы — циркулирующие (серологические) и тканевые (тиссюнальные). Большинство циркулирующих маркёров не имеет никакого прогностического или предиктивного значения. Напротив, тканевые маркёры могут отражать генотип опухоли и объединённые с другими характеристиками (возраст, пол, раса, потеря веса, статус выполнения, сопутствующие болезни, социально-бытовые факторы) способны влиять на выбор режима лечения.
Циркулирующие маркёры для мелкоклеточных опухолей включают раковоэмбриональный антиген (CEA), мелкоклеточную карциному и цитокератины (в том числе CYFRA 21-1), антиген тканевого полипептида (TPA), Ca 15-3, для немелкоклеточных опухолей — NSE и хромогранин A (CgA). Наиболее популярное клиническое использование циркулирующих опухолевых маркёров рака лёгкого заключается в мониторинге заболевания. CgA, наряду с контролем течения заболевания в процессе лечения, может быть полезен для прогноза вероятности рецидива[34].
Циркулирующие маркёры для мелкоклеточных карцином представляют более обширную группу и их специфичность и прогностическое значение намного выше. EA и Cyfra 21-1 являются самыми чувствительными маркёрами для немелкоклеточных неоплазий. Серологический уровень Cyfra 21-1 наиболее высок для плоскоклеточного рака, метастатической стадии рака лёгкого и неудовлетворительного статуса выполнения.
Тканевые опухолевые биомаркёры потенциально используются для изменения режимов терапии больных с немелкоклеточным раком лёгкого. Наряду с другими факторами они являются важным элементом персонифицированного лечения. Для немелкоклеточного рака биомаркёров с достоверным предиктивным или прогностическим значением не найдено[34].
KRAS мутации, как правило, ассоциируются с негативным прогнозом. Прогностическое значение ERCC1 (Excision repair cross-complementing-1) спорно, но International Adjuvant Lung Trial (IALT) показала удлиненный период выживаемости больных с ERCC1-негативными опухолями после адъювантной химиотерапии.
Прогностической ценностью обладают сигнатуры экспрессии определённых генов, хотя сообщенные данные чрезвычайно гетерогенны. Наиболее цитируемые из них включают сигнатуру из 5 генов — DUSP6 (биспецифичная фосфатаза 6), MMD (дифференцирование моноцитов в макрофаги-ассоциированный протеин), STAT1 (сигнальный трансдуктор и активатор транскрипции 1), ERBB3 (v-erb b2 гомолог онкогена птичьего эритробластного лейкоза 3) и LCK (тирозинкиназа лимфоцит специфического протеина) в самых достоверных прогностических генах в хирургически резецированном немелкоклеточном раке лёгкого.[34]
Паттерн экспрессии BRAC1 генов, видимо, предсказывает выживаемость на резецированной стадии I. Соматические активирующие мутации в EGFR тирозинкиназных доменах (экзоны 18-21) являются важной молекулярной детерминантой клинического ответа на лечение с тирозинкиназными ингиторами, Гефитинибом или Ерлотинибом.
RRM1 представляет молекулярную мишень гемцитабина и является компонентом рибонуклеотид-редуктазы, необходимой для продукции дезоксинуклеотидов. Уровни RRM1 протеина в опухолевых образцах предсказывают клинический ответ на терапию больных немелкоклеточным раком лёгкого на поздних стадиях и леченных с гемцитабином[34].
Оценка мутационного статуса рецептора эпидермального фактора роста (EGFR)[править | править код]
В случае метастатического немелкоклеточного рака лёгкого при выявлении мутации EGFR эффективность таргетной терапии на основе ингибиторов EGFR существенно возрастает. До назначения препаратов (гефитиниб, эрлотиниб) проводится молекулярно-генетическая диагностика с целью выявления мутации рецептора. В 2012—2013 годах в России действовала Программа молекулярно-генетической диагностики российского Общества онкологов-химиотерапевтов, в рамках которой тесты на мутацию выполнялись всем пациентам бесплатно[35]. Сейчас в рамках программы совершенствования молекулярно-генетической диагностики Российского общества клинической онкологии работают 22 лаборатории. Пациенты получают тестирование бесплатно при направлении врача[36].
Хирургическое лечение[править | править код]
Хирургическое вмешательство подразделяется на:
При радикальной операции удалению подвергается весь опухолевый комплекс: первичный очаг, регионарные лимфатические узлы, клетчатка с путями метастазирования. Наиболее часто проводятся операции в объёме лобэктомии (удаление одной доли лёгкого), билобэктомии только для правого лёгкого (резекция двух долей лёгкого), пульмонэктомии — удаление лёгкого целиком. Расширенные и комбинированные пульмонэктомии — полное удаление лёгкого с резекцией лимфатических узлов разных групп и удалением соседних органов, проросших опухолью, соответственно. На 1 и 2 стадиях выполняются лобэктомия. На 3А стадии обычно выполняют пульмонэктомию. К условно-радикальной операции добавляют лучевую и лекарственную терапию. Следует учитывать также и то, что часть первичной опухолевой ткани и метастазы иногда не могут быть хирургически удалены ввиду угрозы кровотечения или процессов распада в ателектазе.
Противопоказаниями к радикальной операции являются:
- нерезектабельность — распространение опухоли на соседние ткани и органы, при котором технически невозможно радикально удалить опухоль.
- нецелесообразность ввиду наличия отдалённых метастазов.
- недостаточность функций сердечно-сосудистой и дыхательной систем
- декомпенсированные заболевания внутренних органов
Хирургическому удалению опухоли часто сопутствует широкое удаление корневых, трахеобронхиальных лимфоузлов, клетчатки и лимфоузлов средостения, резекция грудной стенки, перикарда, диафрагмы, бифуркации трахеи, предсердия, магистральных сосудов (аорты, верхней полой вены), мышечной стенки пищевода и других тканей, проросших опухолью.
Лучевая терапия[править | править код]
Лучевое лечение рака лёгкого проводится в послеоперационный период на ложе опухоли и пути регионального лимфотока. При неоперабельных формах рака, в случае отказа больного от оперативного лечения или при наличии серьёзных противопоказаний к оперативному вмешательству лучевая терапия может проводиться как самостоятельный метод лечения.
Лучевая терапия применяется как для радикального, так и паллиативного лечения. При радикальном лучевом лечении облучению подвергают как саму опухоль, так и зоны регионального метастазирования, то есть корень лёгкого, средостение, зоны регионального лимфотока общей дозой 50-70 Гр.
В последнее время возможности лучевой терапии расширились с использованием стереотаксической лучевой терапии тела с синхронизацией с дыханием пациента. Такими возможностями обладают некоторые современные медицинские ускорители и КиберНож. При таком подходе достигаемая точность облучения составляет порядка одного-трёх миллиметров, что позволяет подводить на очаг абляционные дозы излучения, но не требует хирургического доступа и анестезии. Этот метод облучения наиболее востребован при единичных метастазах в лёгкое и при неоперабельном первичном раке лёгкого.
Химиотерапия[править | править код]
При немелкоклеточном раке лёгкого химиотерапия проводится при наличии противопоказаний к хирургическому и лучевому лечению. При этом назначаются следующие препараты: доксорубицин, цисплатин, винкристин, этопозид, циклофосфамид, метотрексат, блеомицин, нитрозомочевина, винорелбин, паклитаксел, доцетаксел, гемцитабин, карбоплатин, винорельбин, иринотекан и др., применяемые курсами с интервалами в 3-4 недели (до 6-7 курсов).
При мелкоклеточном раке лёгкого химиотерапия в составе комплекса с лучевой терапией является наиболее эффективным лечением. Препараты те же, что и при немелкоклеточном раке лёгкого.
Противопоказание к химиотерапии РЛ: тяжелое состояние пациента.
Частичное уменьшение размеров первичной опухоли и метастазов наблюдается не у всех больных, полное исчезновение злокачественного новообразования происходит редко. Химиотерапия при отдалённых метастазах не приводит к излечению (паллиативная химиотерапия), она только снижает тяжесть проявлений заболевания, и незначительно увеличивает продолжительность жизни.
К методам лечения рака лёгкого также относятся[источник не указан 1189 дней]:
- Фотодинамическая терапия
- Химиоэмболизация
- Радиоэмболизация
- Брахитерапия
- Криодеструкция
- Лазерная коагуляция
- Радиочастотная абляция
- Биотерапия
- Иммунотерапия
- Таргетная терапия
В 2018 году Администрацией по контролю за продуктами и лекарствами США (FDA) был одобрен препарат (дурвалумаб) для снижения риска прогрессирования рака у пациентов с неоперабельным немелкоклеточным раком легкого (НМРЛ) третьей стадии, чье заболевание прогрессирует после химиотерапии и радиотерапии. Дурвалумаб способен подавлять лиганд-1 программируемой гибели (PDL1) и стимулировать работу иммунной системы. Ранее он был зарегистрирован FDA для применения среди больных раком мочевого пузыря. Согласно результатам клинического исследования PACIFIC, прошедшего при участии 173 пациентов, дурвалумаб в сравнении с плацебо увеличил показатель выживаемости без прогрессирования до 16,8 месяца (в плацебо-группе этот показатель составил 5,6 месяцев). Частота объективного ответа при применении дурвалумаба и плацебо составила 28,4 % и 16,0 % соответственно.[37]
Моноклональные антитела[править | править код]
Пембролизумаб — иммуноонкологический препарат, является моноклональным антителом, блокирующим взаимодействие рецепторов PD-1 на Т-лимфоцитах иммунной системы и лигандов PD-L1 и PD-L2 на опухолевой клетке. Таким образом препарат реактивирует способность иммунной системы организма бороться со злокачественным новообразованием.[38] Пембролизумаб включен в утвержденный правительством перечень необходимых и важнейших лекарственных препаратов (ЖНВЛП) на 2018 год. Препарат разработан компанией MSD и впервые зарегистрирован в России в ноябре 2016 года. В настоящее время он одобрен к применению на территории страны по трем показаниям: для лечения взрослых пациентов с неоперабельной или метастатической меланомой, в качестве первой линии терапии метастатического немелкоклеточного рака легкого (НМРЛ) с высоким уровнем экспрессии PD-L1 (≥50 %), а также больных с метастатическим НМРЛ, у которых подтверждена экспрессия PD-L1 опухолевыми клетками и наблюдается прогрессирование заболевания во время или после терапии препаратами платины.[39] Монотерапия пембролизумабом продлевает общую выживаемость у ранее нелеченых пациентов с немелкоклеточным раком легкого, по сравнению с химиотерапией.[40][41]
Согласно результатам исследования IMpower132 III фазы, добавление атезолизумаба к терапии первой линии пеметрекседом и химиотерапевтическими препаратами, снижает риск прогрессирования заболевания или смерти у пациентов с неплоскоклеточным НМРЛ. Снижение риска прогрессирования заболевания составило примерно 40 %. Также наблюдалось улучшение общей выживаемости на 4,5 месяца, однако статистическая значимость пока не была достигнута. IMpower132 является открытым рандомизированным исследованием, в котором проводится оценка эффективности и безопасности атезолизумаба комбинации с химиотерапией (цисплатин или карбоплатин и пеметрексед) в сравнении с химиотерапией без атезолизумаба у пациентов с НМРЛ, ранее не получавших химиотерапию. В исследование включено 568 человек.[42]
Паллиативное лечение[править | править код]
Паллиативное лечение рака лёгкого применяется в том случае, когда возможности противоопухолевого лечения ограничены или исчерпаны. Такое лечение направлено на улучшение качества жизни (уменьшение выраженности симптомов) и увеличение продолжительности жизни неизлечимых больных и включает в себя:
- обезболивание
- кислородотерапию
- симптоматическую терапию
- психологическую помощь
- переливание крови
- борьба с анемией
- детоксикацию
- паллиативную лучевую терапию
- паллиативную химиотерапию
- паллиативное хирургическое вмешательство (трахеостомия, гастростомия, энтеростомия, нефростомия и т. д.)
Паллиативная помощь при раке лёгкого применяется для борьбы с одышкой, кашлем, кровохарканьем, болевыми ощущениями. Проводится лечение присоединяющихся к опухолевому процессу пневмонии и пневмонита, возникающих при лучевой и химиотерапии.
Методы паллиативного лечения во многом индивидуальны и зависят от состояния больного.
В случае нелеченого рака лёгкого умирают 87 % больных в течение 2 лет с момента установления диагноза. При использовании хирургического метода можно достичь 30%-й выживаемости больных в течение 5 лет.[источник не указан 2119 дней] Раннее обнаружение опухоли позволяет повысить шансы на излечение: на стадии T1N0M0 она достигает 80 %. Совместное проведение хирургического, лучевого и медикаментозного лечения позволяет поднять 5-летнюю выживаемость ещё на 40 %.[источник не указан 2119 дней] Наличие метастазов значительно ухудшает прогноз.
- ↑ 1 2 3 4 Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ 1 2 В.А. Нидюлин Б.В. Эрдниева. Об эпидемиологии рака лёгких (рус.) // Медицинский вестник Башкортостана : обзорная статья. — Башкирский государственный медицинский университет, 2009. — Т. 4, № 1. — С. 66—71. — ISSN 1999-6209.
- ↑ Vaporciyan, AA; Nesbitt J. C., Lee JS et al. Cancer Medicine (неопр.). — B C Decker, 2000. — С. 1227—1292. — ISBN 1-55009-113-1.
- ↑ Biesalski, HK; Bueno de Mesquita B., Chesson A et al. European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel (англ.) // CA: A Cancer Journal for Clinicians (англ.)русск. : journal. — Smoking is the major risk factor, accounting for about 90% of lung cancer incidence., 1998. — Vol. 48, no. 3. — P. 167—176; discussion 164—166. — DOI:10.3322/canjclin.48.3.167. — PMID 9594919. (недоступная ссылка)
- ↑ Этиология рака лёгких. (недоступная ссылка) Пер. с англ. Н. Д. Фирсова (2017)
- ↑ Hecht, S. Tobacco carcinogens, their biomarkers and tobacco-induced cancer (англ.) // Nature Reviews Cancer : journal. — Nature Publishing Group, 2003. — October (vol. 3, no. 10). — P. 733—744. — DOI:10.1038/nrc1190. — PMID 14570033.
- ↑ Sopori, M. Effects of cigarette smoke on the immune system (англ.) // Nature Reviews Immunology. — Nature Publishing Group, 2002. — May (vol. 2, no. 5). — P. 372—377. — DOI:10.1038/nri803. — PMID 12033743.
- ↑ Peto, R; Lopez A. D., Boreham J et al. Mortality from smoking in developed countries 1950–2000: Indirect estimates from National Vital Statistics (англ.). — Oxford University Press, 2006. — ISBN 0-19-262535-7.
- ↑ Villeneuve, PJ; Mao Y. Lifetime probability of developing lung cancer, by smoking status, Canada (англ.) // Canadian Journal of Public Health (англ.)русск. : journal. — 1994. — November (vol. 85, no. 6). — P. 385—388. — PMID 7895211.
- ↑ Chlebowski RT et al. Non-small cell lung cancer and estrogen plus progestin use in postmenopausal women in the Women’s Health Initiative randomized clinical trial (англ.) // Journal of Clinical Oncology (англ.)русск. : journal. — 2009. — Vol. 27, no. 155. — P. CRA1500.
- ↑ US Department of Health and Human Services. The Health Benefits of Smoking Cessation: a Report of the Surgeon General (неопр.) (PDF) vi, 130, 148, 152, 155, 164, 166. Centers for Disease Control (CDC), Office on Smoking and Health. (30 сентября 1990). Дата обращения 18 ноября 2007.
- ↑ Nordquist, LT; Simon G.R., Cantor A et al. Improved survival in never-smokers vs current smokers with primary adenocarcinoma of the lung (англ.) // Chest : journal. — American College of Chest Physicians, 2004. — August (vol. 126, no. 2). — P. 347—351. — DOI:10.1378/chest.126.2.347. — PMID 15302716. Архивировано 6 декабря 2008 года.
- ↑ Tammemagi, CM; Neslund-Dudas C., Simoff M., Kvale P. Smoking and lung cancer survival: the role of comorbidity and treatment (англ.) // Chest : journal. — American College of Chest Physicians, 2004. — January (vol. 125, no. 1). — P. 27—37. — DOI:10.1378/chest.125.1.27. — PMID 14718417. Архивировано 6 декабря 2008 года.
- ↑ Centers for Disease Control (CDC). 1986 Surgeon General’s report: the health consequences of involuntary smoking (англ.) // Morbidity and Mortality Weekly Report (англ.)русск. : journal. — Centers for Disease Control and Prevention, 1986. — December (vol. 35, no. 50). — P. 769—770. — PMID 3097495.
* National Research Council. Environmental tobacco smoke: measuring exposures and assessing health effects (англ.). — National Academy Press (англ.)русск., 1986. — ISBN 0-309-07456-8.
* EPA. Respiratory health effects of passive smoking: lung cancer and other disorders
Заразный рак — Википедия
Зара́зный рак (англ. transmissible cancer), или трансмисси́вная злока́чественная о́пухоль — форма рака, при которой сами раковые клетки или их скопления могут передаваться от одной особи к другой, при этом у особи-реципиента они не отторгаются иммунной системой, а приводят к развитию рака. Иными словами, в случае заразного рака инфекционным агентом являются сами раковые клетки. Достоверно известны три случая заразного рака: трансмиссивная венерическая опухоль собак, лицевая опухоль тасманийского дьявола и трансмиссивная лейкемия двустворчатых моллюсков. У человека на данный момент не известно заразных форм рака.
Трансмиссивная венерическая опухоль собак[править | править код]
Первым описанным случаем заразного рака стала трансмиссивная венерическая опухоль собак (англ. canine transmissible venereal tumor, CTVT). Помимо собак, заболевание обнаружено у волков, койотов и шакалов. Возможность передачи этой опухоли от одной особи к другой экспериментально продемонстрировали в 1876 году. Идентичность клеток CTVT стала очевидной после выявления одинаковых хромосомных перестроек, а также обнаружения интеграции ретротранспозона LINE1[en] перед геном Myc у всех клеток опухоли. Передача опухоли (плотного образования до 10 см в диаметре) происходит при половом контакте, и у новой особи опухоль, как правило, развивается на гениталиях. Любопытно, что клетки CTVT постоянно заимствуют митохондриальные геномы своих хозяев. Вероятно, митохондриальные геномы опухолевых клеток быстро приходят в негодность из-за многочисленных мутаций. Как правило, CTVT в течение нескольких месяцев после активного роста регрессирует, не приводя к гибели собаки, однако в некоторых случаях регрессии опухоли не происходит. Описаны даже случаи метастазирования CTVT. Орган или ткань, от которых произошли клетки CTVT, неизвестны[1][2][3].
По оценкам, CTVT появилась очень давно — от 10 тысяч до 12 тысяч лет назад, что делает ее самой древней самоподдерживающейся линией клеток[en] (первой искусственной самоподдерживающейся линией стала HeLa, произошедшая от клеток рака шейки матки). Она обнаружена у собак на всех континентах, кроме Антарктиды[2]. Предполагают, что CTVT привела к гибели древнейших американских домашних собак, прибывших на континент вместе с первыми поселенцами около 15 тысяч лет назад. Судя по анализу древних геномов, клетки CTVT генетически гораздо ближе к первым американским собакам, чем к современным животным, из-за чего иммунная система первых не была в состоянии эффективно отторгать опухоль[4].
Лицевая опухоль тасманийского дьявола[править | править код]
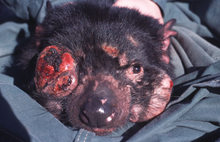 Лицевая опухоль дьявола
Лицевая опухоль дьяволаВпервые лицевая опухоль тасманийского дьявола (англ. devil facial tumor disease 1, DFTD1) была описана в 1996 году на северо-востоке Тасмании. Передача этой крайне агрессивной опухоли происходит при укусах, которые служат важным средством социального общения животных. Трансмиссивный характер опухоли стал очевиден после обнаружения уникальных хромосомных перестроек во всех опухолевых клетках, а также после полного секвенирования геномов[en] клеток двух различных опухолей[5].
В 2014 году на юго-востоке Тасмании обнаружили другую линию раковых клеток лицевых опухолей тасманийского дьявола (DFTD2). Пока выявлено 5 особей с DFTD2, причем все они были самцами. Родоначальником DFTD1 была самка, в то время как DFTD2 появилась у самца. Возможно, самки каким-то образом распознают клетки DFTD2 как чужеродные и избавляются от них, однако делать какие-либо заключения преждевременно в силу недостатка данных. Эпидемиология DFTD2 еще не изучена, но проявления DFTD1 и DFTD2 очень схожи: оба заболевания сопровождаются ростом опухолей до 10 см в диаметре на лице и шее животных. Со временем опухоли подвергаются некрозу и воспаляются, приводя к значительным изменениям анатомии челюсти животного, из-за которых оно не может питаться и пить. Кроме того, в 65 % случаев лицевая опухоль метастазирует[1][2].
Генетические маркеры и кариотипы указывают, что DFTD1 и DFTD2 возникли у разных особей. Клетки DFTD1 произошли от шванновских клеток, образующих миелиновую оболочку периферических нервов, а происхождение клеток DFTD2 еще неизвестно. В отличие от опухоли собак, DFTD всегда приводит к летальному исходу, что представляет серьёзную угрозу для тасманийского дьявола как вида. Описаны только 6 животных, у которых развился иммунный ответ на клетки опухоли[1][2][3].
Трансмиссивная лейкемия двустворчатых моллюсков[править | править код]
По меньшей мере 15 видов двустворчатых моллюсков подвержены смертельной трансмиссивной лейкемии. Опухолевые клетки при этом заболевании происходят от гемоцитов — клеток, циркулирующих в гемолимфе. Первые случаи заболевания описаны в 1970-х годах, и с тех пор болезнь начала быстро распространяться по восточному побережью Северной Америки. Иногда происходят вспышки заболевания, когда более 90 % популяции оказывается зараженной. Клетки разных видов трансмиссивной лейкемии характеризуются значительным увеличением числа копий ретротранспозонов в одних и тех же участках генома[1][2][3].
Возможно, перемещение ретроэлементов запускается факторами внешней среды, такими как перенаселенность, загрязнение, изменение температуры воды. К настоящему времени трансмиссивная лейкемия детально изучена у песчаной мии (Mya arenaria), мидий Mytilus trossulus[en], съедобной сердцевидки (Cerastoderma edule) и Polititapes aureus, и у каждого вида имеется своя независимая линия трансмиссивной лейкемии. У сердцевидки обнаружены две независимые трансмиссивные лейкемии, как у тасманийского дьявола[1][2][3].
Интересно, что лейкемия Polititapes aureus была получена им от другого вида двустворчатых моллюсков — Venerupis corrugata[en], — который в настоящее время лейкемии не подвержен, несмотря на общность местообитания с P. aureus. Вероятно, ему удалось приобрести резистентность к этому заболеванию. Передача раковых клеток происходит через морскую воду, которая проникает в организм моллюска при фильтрации. Со временем раковые клетки распространяются по всем органам и тканям заражённого животного[1][2][3].
Передача раковых клеток от одного человека к другому — чрезвычайно редкое явление. Как правило, она происходит при пересадке органов, так как иммунная система реципиента искусственно угнетается с целью предотвратить отторжение трансплантата. Другие случаи относятся к передаче раковых клеток от матери плоду, перемещению лейкемийных клеток между близнецами в утробе матери, а также передаче клеток внеплодной хориокарциномы[en] от плода матери[6]. Недавно описали заражение пациента со СПИДом раковыми клетками обитающего в его кишечнике карликового цепня. Во всех этих случаях целостность физических и иммунных барьеров организма была нарушена[1][2].
Известно всего лишь несколько случаев передачи чужеродных раковых клеток людям с нормальным иммунитетом. Один хирург случайно занес себе в руку раковые клетки во время операции. Другой случай произошел с исследователем, который по неосторожности занес себе иглой клетки из линии аденокарциномы, что привело к образованию небольшой опухоли. В этих двух случаях опухоли успешно удалили без дальнейших рецидивов[2].
Клетки любой раковой опухоли, как заразной, так и незаразной, вынуждены избегать действия иммунной системы хозяина, чтобы спастись. Один из современных способов лечения рака основан на том, чтобы вернуть раковые клетки под надзор иммунитета. Перед клетками заразного рака стоит еще более трудная задача. Чтобы заразить другую особь, им необходимо каким-то образом спастись от иммунной системы, для которой они являются чужеродными клетками и, следовательно, подлежат уничтожению. У челюстноротых позвоночных животных ключевую роль в распознавании своего и чужого играют молекулы главного комплекса гистосовместимости (англ. main histocompatibility complex, MHC). В клетках CTVT наблюдается пониженная экспрессия генов MHC, а также генов, связанных с презентацией антигенов и апоптозом[1][2].
Предполагают, что тасманийские дьяволы не развивают эффективного иммунного ответа против опухоли в силу низкого разнообразия MHC. Дело в том, что в начале XX века численность популяции дьяволов резко сократилась, что привело к снижению генетического разнообразия. Впрочем, в экспериментах по трансплантации кожи одного дьявола другому отторжение трансплантата всё-таки происходило. Оказалось также, что клетки DFTD тоже понижают экспрессию MHC, как и клетки опухоли собак. У людей перенос раковых клеток от матери к плоду возможен, потому что эмбрион имеет один аллель MHC от матери, и, если опухолевые клетки потеряют ту аллель, которой у эмбриона нет, они не будут распознаны плодом как чужеродные. У двустворчатых моллюсков, как и у всех беспозвоночных, MHC нет. Однако какой-то механизм распознавания своего и чужого у них всё-таки существует, так как их лейкемии, как правило, связаны с одним конкретным видом. Возможно, это достигается при помощи того же механизма, что препятствует слиянию колоний оболочников разных видов[1][2].
Стоит отметить, что клетки CTVT и DFTD сохраняют способность к экспрессии генов MHC, а не утрачивают ее необратимо. Например, если обработать клетки DFTD1 интерфероном γ[en], экспрессия генов MHC резко возрастет, а также восстановится способность к процессингу[en] и презентации антигенов. Вышеупомянутые шесть тасманийских дьяволов, развившие иммунный ответ против опухоли, имеют антитела к опухолевым клеткам, синтезирующим MHC, и у двух животных даже произошла спонтанная регрессия опухоли. У одного из дьяволов в опухоль проникли CD4+ и CD8+ T-лимфоциты. Неизвестно, сформировалась ли у этих животных иммунологическая память[en] к опухолевым клеткам[1][2].
Регрессия CTVT, которая наблюдается у большинства собак, начинается с увеличения доли опухолевых клеток, экспрессирующих MHC. Вместе с этим CD4+ и CD8+ T-лимфоциты начинают проникать в опухоль и оказывают на ее клетки цитотоксическое действие. Вероятно, интерлейкин 6 и интерферон γ, вырабатываемые Т-лимфоцитами в опухоли, запускают образование MHC в раковых клетках[2].
Опухолевые клетки, не экспрессирующие MHC, могут стать жертвами других клеток иммунной системы — натуральных киллеров. Чтобы избежать этого, клетки CTVT выделяют цитокины, подавляющие иммунный ответ, такие как TGF-β. Секреция TGF-β наблюдается в фазе роста опухоли и на первых этапах стационарной фазы. Когда T-лимфоциты начинают синтезировать интерлейкин 6 и интерферон γ, развивается более мощная воспалительная реакция, нивелирующая эффект TGF-β. Рост DFTD, по всей видимости, от TGF-β не зависит[2].
Эволюция линий клеток заразного рака[править | править код]
Генетически клетки заразных опухолей, да и многих раковых опухолей вообще, отличаются от своих хозяев. Если жизнь «обычных» раковых клеток обрывается вместе со смертью хозяина, то время существования линии заразных раковых клеток существенно превышает время жизни одной особи за счет передачи от одного организма к другому. В случае CTVT линия заразных раковых клеток существует более 10 тысяч лет. Поскольку эволюция и размножение таких клеток совершенно независимы от хозяина, возникает соблазн даже рассматривать линии заразных раковых клеток как самостоятельные виды[1].
В принципе, процесс метастазирования, то есть смены местообитания раковых клеток в пределах одного организма, схож с передачей раковых клеток от одной особи к другой. В обоих случаях раковые клетки эволюционируют по Дарвину, приобретая мутации, которые потом отбраковываются естественным отбором сообразно условиям окружающей среды. Кроме того, и те, и другие клетки вынуждены изобретать разнообразные приспособления, чтобы избежать уничтожения иммунной системой хозяина[2].
Клетки CTVT характеризуются уникальной для опухолевых клеток стабильностью. В них почти не происходят мутации и хромосомные перестройки, и клетки в пределах опухолей удивительно однородны. На основании этого ученые заключили, что эволюция клеток CTVT, вначале сопровождавшаяся многочисленными мутациями и перестройками, в данный момент вышла на плато. Клетки CTVT достигли тонкого равновесия со своим хозяином: с одной стороны, они не убивают его, однако долгое время, вплоть до полной регрессии опухоли, собака-хозяин служит в роли переносчика опухолевых клеток. Клетки DFTD, напротив, находятся на ранних этапах эволюции и еще далеки от равновесия со своим хозяином[3].
Активация ретротранспозонов в клетках, ставших впоследствии клетками лейкемии двустворчатых моллюсков, вероятно, стала следствием чрезвычайной геномной нестабильности. Эти клетки содержат больше ДНК, чем нормальные клетки, и нередко являются анеуплоидными или тетраплоидными. Более того, клетки лейкемии в пределах одного организма могут различаться числом некоторых микросателлитов и заменами в митохондриальной ДНК[3].
В начале 2019 года в статье нескольких исследователей[7] была сформулирована и проанализирована гипотеза о том, что, поскольку известные клетки заразного рака могут рассматриваться как одноклеточные паразиты, эволюционировавшие из многоклеточных организмов, то когда-то подобные клетки могли в итоге эволюционировать в многоклеточные организмы, чьи потомки дошли до наших дней. В работе был проведен анализ геномов четырех выбранных групп организмов — из типов Placozoa, Dicyemida, Orthonectida и подкласса Myxosporea. Для первых трех выбранных групп «гипотеза SCANDAL» не подтвердилась, для последнего (Myxosporea) она представляется правдоподобной, но для окончательного вывода мало данных.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 Metzger Michael J., Goff Stephen P. A Sixth Modality of Infectious Disease: Contagious Cancer from Devils to Clams and Beyond (англ.) // PLOS Pathogens. — 2016. — 27 October (vol. 12, no. 10). — P. e1005904. — ISSN 1553-7374. — DOI:10.1371/journal.ppat.1005904. [исправить]
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Siddle H. V. Cancer as a contagious disease (англ.) // HLA. — 2017. — 15 February (vol. 89, no. 4). — P. 209—214. — ISSN 2059-2302. — DOI:10.1111/tan.12980. [исправить]
- ↑ 1 2 3 4 5 6 7 Ujvari Beata, Papenfuss Anthony T., Belov Katherine. Transmissible cancers in an evolutionary context (англ.) // BioEssays. — 2016. — July (vol. 38). — P. S14—S23. — ISSN 0265-9247. — DOI:10.1002/bies.201670904. [исправить]
- ↑ Ní Leathlobhair Máire, Perri Angela R., Irving-Pease Evan K., Witt Kelsey E., Linderholm Anna, Haile James, Lebrasseur Ophelie, Ameen Carly, Blick Jeffrey, Boyko Adam R., Brace Selina, Cortes Yahaira Nunes, Crockford Susan J., Devault Alison, Dimopoulos Evangelos A., Eldridge Morley, Enk Jacob, Gopalakrishnan Shyam, Gori Kevin, Grimes Vaughan, Guiry Eric, Hansen Anders J., Hulme-Beaman Ardern, Johnson John, Kitchen Andrew, Kasparov Aleksei K., Kwon Young-Mi, Nikolskiy Pavel A., Lope Carlos Peraza, Manin Aurélie, Martin Terrance, Meyer Michael, Myers Kelsey Noack, Omura Mark, Rouillard Jean-Marie, Pavlova Elena Y., Sciulli Paul, Sinding Mikkel-Holger S., Strakova Andrea, Ivanova Varvara V., Widga Christopher, Willerslev Eske, Pitulko Vladimir V., Barnes Ian, Gilbert M. Thomas P., Dobney Keith M., Malhi Ripan S., Murchison Elizabeth P., Larson Greger, Frantz Laurent A. F. The evolutionary history of dogs in the Americas (англ.) // Science. — 2018. — 5 July (vol. 361, no. 6397). — P. 81—85. — ISSN 0036-8075. — DOI:10.1126/science.aao4776. [исправить]
- ↑ Kreiss A., Tovar C., Obendorf D. L., Dun K., Woods G. M. A Murine Xenograft Model for a Transmissible Cancer in Tasmanian Devils (англ.) // Veterinary Pathology. — 2010. — 22 September (vol. 48, no. 2). — P. 475—481. — ISSN 0300-9858. — DOI:10.1177/0300985810380398. [исправить]
- ↑ Greaves Mel, Hughes William. Cancer cell transmission via the placenta (англ.) // Evolution, Medicine, and Public Health. — 2018. — 1 January (vol. 2018, no. 1). — P. 106—115. — ISSN 2050-6201. — DOI:10.1093/emph/eoy011. [исправить]
- ↑ Panchin A. Y., Aleoshin V. V., Panchin Y. V. From tumors to species: a SCANDAL hypothesis // Biology Direct, 2019, 14:3
от чего возникает болезнь, бывает ли предрасположенность к раку
Онкология считается серьёзным заболеванием, приводящим к смерти больного. Количество раковых болезней увеличивается. Медицинские учёные стараются изучить и выявить точные факторы возникновения злокачественной опухоли. Для некоторых видов онкологических заболеваний указываются конкретные причины развития рака.
Основные факторы возникновения рака
Рак возникает при патологическом дефекте клеток. Они начинают активно делиться, что приводит к образованию злокачественных наростов. Опухоль возникает во внутренних тканях органа и в процессе развития поражает рядом расположенные органы и структуры. Распространение раковых клеток по организму происходит с помощью лимфы и кровеносных сосудов. Процесс называется метастазированием.
Рассмотрим причины заболевания раком более детально.
Несбалансированный рацион
Человек состоит из того, что он потребляет в еду. По статистике третья часть раковых заболеваний возникает на фоне неправильного питания. Спровоцировать онкологию может действие канцерогенов, находящихся в пище. В продуктах содержатся компоненты, способные повлиять на появление болезни при употреблении в больших объёмах. Это углеводы и транс-жиры. Пережаренная пища содержит увеличенное количество канцерогенов.
Возросший объём белка также приводит к онкологии. В рационе должен присутствовать достаточный объём пищи растительного происхождения – овощи, фрукты. Их нужно выбирать в зависимости от сезона и места выращивания, так как они могут содержать нитраты, нитриты.
Ещё одним канцерогеном, содержащимся в еде, считается бензпирен. Обнаруживается в копчёных продуктах, их стоит ограничить в потреблении либо полностью исключить.
Наследственная предрасположенность
Онкологическое заболевание развивается при врождённой или генетической расположенности, включая разные мутации. Даже если человек не состоит в группе риска, это не спасает от развития опухолей различного характера. Вероятность появления рака составляет 20%. У людей, обладающих предрасположенностью наследственного характера, риск заболеть раком выше.


Вирусные инфекции
В некоторых случаях спровоцировать появление злокачественной опухоли могут вирусы. Заражение организма вирусом папилломы приводит к раку шейки матки, инфицирование организма Т-лимфотропной инфекцией провоцирует появление редкого и быстро развивающегося вида лейкоза. Причины возникновения первичной опухоли рака печени связаны с заражением органа хроническими формами гепатита. Определяются вирусы, способные повлиять на развитие онкологического заболевания желудка. Вирусные инфекции обеспечивают появление раковых клеток в одном случае из десяти.
Пагубные привычки
Медицинские исследования доказали связь между онкологической болезнью и курением. В первую очередь возникает рак лёгких. Человек, регулярно употребляющий табачные изделия, рискует спровоцировать появление раковой опухоли глотки, ротовой полости, пищевода. Курение относится к основному фактору развития онкологии. По статистике каждый пятый больной умирает от ракового заболевания, образовавшегося после употребления табачной продукции. Окружающие курильщика люди рискуют заболеть от вдыхания табачного дыма, который содержит вредные компоненты: мышьяк, радиоактивные вещества (радон, полоний), нитрозамины, 2-нафтинамил, ПАУ.
Потребление избытка алкогольных напитков тоже считается фактором появления рака. Алкоголь с высоким содержанием спирта приводит к ухудшению в работе печени и органов желудочно-кишечного тракта, может развиться онкология.
Воздействие окружающей среды
Основной причиной возникновения злокачественной опухоли считаются токсичные вещества из внешней среды. К факторам, оказывающим влияние на раковый процесс, относят химические компоненты, присутствующие в воздухе и радиоактивное воздействие. К опасным веществам относятся средства бытовой химии, пластмассовые изделия, асбест. Канцерогенные компоненты содержатся в выхлопных газах, промышленных выбросах. Бензол, диоксиды, формальдегид – эти компоненты обнаруживаются в воздухе и влияют на патологические изменения клеток.


Облучение радиацией возможно повсюду – дома, на улице, при медицинском обследовании. Для постройки дома могут использоваться радиоактивные составляющие, длительное пребывание на солнце негативно воздействует на кожные покровы. Получение загара в солярии также может спровоцировать появление рака кожи. Использование рентгеновского излучения не считается серьёзной причиной появление опухоли. Доза облучения небольшая, вред организму наносится невысокий.
Продолжительное депрессивное состояние
Учёные выявили связь между онкологическим заболеванием и психологическим восприятием. Продолжительный стресс не влияет на развитие раковых узлов. Но ослабляет работу иммунной системы, что не даёт организму защититься от появления онкологических клеток.
В депрессивном состоянии эндокринные железы производят гормоны, подавляющие деятельность иммунитета. Под воздействием оказываются нейтрофилы и макрофаги – основные клетки, специализирующиеся на уничтожении опухолевых узлов. Эстрогены увеличивают разрастание тканей за счёт деления клеток, оказывая действие на восприимчивые к нему эндометрий, молочной железы, яичников. Ситуация повышает вероятность злокачественного новообразования. Поэтому нужно контролировать ситуацию, не поддаваться стрессовым факторам. Это важно в тот момент, когда человек заболел раком.
Недостаточная физическая активность
Физические нагрузки в достаточном объёме демонстрируют благоприятное воздействие на организм, повышают работоспособность кишечника. Токсичные компоненты не задерживаются в пищеварительном тракте, не оказывают неблагоприятное влияние на внутренние ткани органа, не дают возникнуть опухоли. Физическая активность улучшает кровоток, возрастает насыщение крови кислородом, снижение гипоксии приводит к устранению клеточных повреждений.
Защитная деятельность организма
Человеческий организм включает увеличенное число клеток трёх типов: соединительнотканной, мышечной, эпителиальной. В здоровом теле клеточная деятельность проходит по определённой генетической программе. У каждой клетки существует обозначенный период жизни. Организм обновляется из-за появления очередных клеток.
Клетка проходит определённый путь развития: зарождение и деление, созревание, специальная направленность, активность, увядание и заложенная гибель. Аномальные мутации происходят постоянно, но запрограммированная регуляция в организме уничтожает изменённые клетки.
Влияние наружных или внутренних причин оказывает сбой, аномальные клетки не уничтожаются, продолжают быстро развиваться на участке образования самостоятельно.
Опухоль развивается поэтапно:
- Избыток незрелых клеток.
- Образование узла доброкачественного характера. Стадия может не наблюдаться у некоторых видов рака или быть конечной ступенью развития. Доброкачественное новообразование медленно развивается, процесс метастазирования отсутствует. Опасна давлением на близлежащие нервные волокна, сосуды кровеносной системы.
- Дисплазия. Изменённые клетки продолжают развиваться, доброкачественное образование переходит в злокачественное.
- Предраковое развитие – опухоль присутствует, но может произойти регресс. Клетки находятся в ограниченной области.
- Рак инвазивного характера. Разрастание онкологического узла сопровождается метастазами, воспалительными процессами. Заболевание считается неблагоприятным для выздоровления при выявлении метастазов в отдалённых органах.
Невосприимчивость к раковым болезням обеспечивается определёнными процессами: антиканцерогенный, антитрансформационный, противоклеточный.
Начальная защита
Иммунная структура и печень предоставляют защиту от канцерогенных составляющих. Проходящие сквозь печень вредные компоненты проходят этап обезвреживания с помощью окисления с помощью атомов кислорода и соединение с альбумином. Канцерогены превращаются в безвредные компоненты, которые выводятся из организма желчью, в кале или моче.
Вторая защита
Витамины A, C, E способствуют восстановлению и целостности клеточных оболочек, нарушение которых происходит из-за химических компонентов или физиологическими причинами.
Антитрансформационный процесс предотвращает перерождение клеток в злокачественные. Это происходит следующими путями:


- Если во время клеточного деления возникает дефект ДНК, происходит запуск ферментов для восстановления изменённой области. При недопустимости замены подключается ген, который приводит к гибели дефектной клетки.
- Аллогенное ингибирование – расположенные рядом клетки вырабатывают специальные вещества для торможения процесса клонирования опухоли.
- Контактное торможение – происходит подавление развития опухолевых клеток.
Третья защита
Противоклеточные процессы происходят с помощью иммунной структуры. Изменённые клетки определяются Т-лимфоцитами. Они могут повреждать клоны или выделять цитотоксические компоненты. После воздействия лимфоцитов подключаются макрофаги. Антитела (альфа, бета) повышают появление кислорода, перекисных соединений нейтрофилов и макрофаг, провоцируют тромбоз, который приводит к отмиранию тканей опухоли.
Онкологический узел может изменить свою структуру, что приводит к невозможности уничтожения.
Группа риска
Выявлено множество видов онкологических болезней. Часто наблюдаются злокачественные новообразования. Раковые процессы с первичным возникновением обнаруживаются в системах и органах. Страдают:
- лёгкие, ткани молочной и щитовидной железы;
- орган пищеварения, почки, поджелудочной железы, печень;
- предстательная железа, участки тонкой и прямой кишки, шейка матки и маточное тело, яичники, мочевыводящая система;
- кожная карцинома и слизистого слоя, кровоток и лимфа.
Повышенному риску заболеть онкологией подвержены следующие возрастные категории:
- лимфосистема, кровоток – до тридцати лет;
- желудка и лимфоузлов, щитовидка и грудной железы, яичники, шейка матки, лейкоз – от 30-40 лет;
- старше сорока – органы дыхания, ЖКТ, грудная железа, репродуктивные органы у женщин;
- дыхательная и желудочно-кишечная системы, кожа – от пятидесяти и старше.


У детей может развиться онкология при внутриутробном развитии, если женщина проходила лечение беременная. Основная причина детской смертности от онкологии – рак головного мозга или лейкемия (онкология крови).
Лечение и профилактика рака
Выявление рака на ранних стадиях позволяет вылечить заболевание в 95%. Чтобы определить онкологический процесс, используют диагностические обследования (КТ, МРТ, МСКТ), которые предоставляют шанс увидеть в режиме точного времени новообразование. Результаты документируются и отправляются на дополнительные анализы. Лечение даёт высокие показатели при хирургическом вмешательстве.
При определении онкологии на последних этапах протекания вылечить её сложно. Происходит удаление органов полностью или частично, осложняется жизнь больного, сокращается показатель выживаемости. Воздействие химиотерапии и лучевой терапии не всегда облегчает состояние пациента.
Самостоятельным лечением с применением народной медицины заниматься не стоит. Если возникло желание удалить родинку, стоит посетить медучреждение, чтобы врач удалил невус. Родинка не считается злокачественным образованием, она не спровоцирует появление рака кожи. После удаления, чтобы не начался онкологический процесс, стоит следить за появлением новых образований, изменением размеров и цвета.
Главная профилактика заболевания заключается в том, чтобы регулярно проходить медосмотры, посетить врача при достижении возраста входящего в группу риска. Стоит исключить пагубные привычки, больше двигаться, потреблять в пищу полезные продукты, избегать стрессовых ситуаций. Использовать средства защиты от солнечных лучей при длительном пребывании на воздухе.
Чтобы захватить болезнь на первых ступенях развития, нужно следить за изменениями организма и выявлять симптомы заболеваний.
Из-за чего появляется рак у человека?
Ни для кого не секрет, что рак – это опаснейшее злокачественное заболевание, которое нарушает рост клеток человеческого организма, превращая их в онкологические. Для каждого типа ткани считается абсолютно нормальным, когда клетки растут и делятся. Но если данный процесс приостанавливается и новые клетки не появляются, то в тканях возникают новообразования. Поэтому многих людей интересует информация, рак из-за чего появляется. В этой статье и рассмотрим все нюансы.
В организме каждого человека присутствует специальный механизм, который отвечает за правильный рост и деление клеток всех типов тканей. Однако существуют некоторые факторы, которые провоцируют сбой этого механизма, тем самым вызывая рак. Учтите, чем раньше вы сможете диагностировать заболевание, тем больше у вас шансов его вылечить.
Что представляет собой рак
Прежде чем понять, рак из-за чего появляется, нужно разобрать основные особенности этого заболевания. Обратите внимание на то, что существуют доброкачественные и злокачественные опухоли. Так вот, рак – это именно злокачественные новообразования. Охарактеризовать данный недуг можно так:
— клетки начинают очень быстро и неконтролируемо делиться;
— болезнь может «нападать» также и на соседние органы и ткани;
— а вот метастазы могут образовываться абсолютно в любых органах.
Если данное заболевание просто игнорировать, то оно начнет разрастаться и поражать соседние органы, причем для рака абсолютно неважно, какие именно. Когда заболевание перешло на метастазный уровень, плохие клетки начинают перемещаться с помощью крови по всему организму и поселяться в разных органах. Там они приживаются и активно делятся. Лечить заболевание очень трудно, ведь, даже если убить тысячи клеток, но оставить лишь одну, заболевание снова начнет прогрессировать.

Рак может возникать, независимо от возраста пациента. Но чем старше он становится, тем тяжелее лечить заболевание. Ведь у людей преклонного возраста уже не такой сильный иммунитет, и рак может распространяться по телу намного быстрее.
Откуда появляется рак: причины
На самом деле существует огромное множество разнообразных причин, которые могут привести к появлению атипичных клеток. Данное заболевание известно уже довольно давно, но в последние два десятилетия процент появления недуга резко увеличился и продолжает расти и дальше. А это говорит о том, что существуют некоторые факторы, которые способствую появлению данной болезни.
Канцерогенные факторы
Канцерогены – это одна из распространенных причин развития раковых клеток в человеческом организме. Существуют канцерогены, способные не только увеличивать скорость деления клеток, но также и оказывать мутагенное влияние, повреждая структуру самой ДНК. Данные вещества могут иметь три типа происхождения: физическое, биологическое и химическое.
К первому типу можно отнести ультрафиолетовые и рентгеновские лучи, а также гамма-излучение. Именно поэтому старайтесь избегать долгого пребывания под жарким палящим солнцем.
К биологическим факторам можно отнести некоторые заболевания. Самыми распространенными из них считаются вирус Эпштейна — Барр, а также папилломавирус.
Канцерогены химического характера
Рак из-за чего появляется – это вопрос, ответив на который можно уберечь себя от столь опасного недуга. Химические канцерогены – это вещества, которые при попадании в организм могут вызвать рак.
Вот перечень самых опасных из них:
— мышьяк;
— разнообразные красители;
— нитраты, кадмий и бензол;
— афлатоксин, асбест и формальдегид;
— также не стоит забывать и о различных пищевых добавках.
Большое количество канцерогенов попадает в воздух при сжигании мусора, а также при горении пластмассы и нефти. В промышленных городах воздух содержит огромное количество вредных веществ. И чем город больше, тем больше в нем и канцерогенов.
Если рассматривать, рак из-за чего появляется, то не стоит забывать и о продуктах питания. Ни в коем случае не употребляйте чрезмерно большое количество очень жирной пищи. Покупая продукты в магазинах, обязательно обращайте внимание на их состав, ведь практически в каждом из них вы сможете найти канцерогены, которые принято обозначать буквой Е. Причем Е123 и Е121 считаются максимально опасными для человеческого здоровья.
Обратите внимание на продукты питания
Если вас интересует, от чего появляется рак, то в первую очередь задумайтесь о том, что вы едите. Постарайтесь избегать различных копченые продуктов, таких как ветчина, бекон, колбаса и сосиски. Также обязательно читайте состав таких продуктов, как белый хлеб и макароны. Откажитесь от попкорна, сладких газировок и готовых завтраков.
Вирусы
Вирусы – это одна из основных причин, от чего появляется рак. Чаще всего к нему приводят такие инфекции, как папиллома, полиома, ретровирус, аденовирус и вирус Эпштейна — Барр. В онкологии пятнадцать процентов всех случаев заболевания рака составляют именно вирусные заболевания. Довольно часто инфекции, способные повлиять на развитие рака, просто спят в организме человека и могут передаться следующему поколению.
Специалисты советуют при появлении папиллом на теле сдать соответствующие анализы. Это поможет определить, злокачественное или нет это образование. И только исходя из полученной информации можно назначать дальнейшее лечение.
Несколько слов о радиации
Радиация – это еще одна причина, почему появляется рак. Чтобы клетки человеческого тела начали мутировать, необязательно долгое время находиться в помещении с повышенным уровнем радиации. Будет достаточно и простого пребывания под солнечными лучами. Конечно, ультрафиолет в малых дозах полезен для человеческого здоровья, но вот в случаях с чрезмерной любовью к загоранию у человека может появиться такое заболевание, как меланома.
Поэтому не рекомендуется злоупотреблять походами в солярий, а при походах на пляж все же контролируйте временные промежутки нахождения под палящим солнцем. Обязательно используйте специальные средства защиты от солнца. А также ходите на пляж только утром и вечером. В таких временных рамках солнце воздействует на человеческую кожу наиболее щадяще.
Если у вас есть большие родинки и другие кожные заболевания, обязательно прячьте их от ультрафиолетового воздействия.
Наследственный фактор
Наследственность – это еще одна причина, почему появляется рак у человека. Если гены работают правильно, то они способны поддерживать нормальное деление клеток. Но если в организме происходит мутация, то этот процесс полностью нарушается. Обратите внимание на то, что если у кого-то в семье был рак, то есть большая вероятность передачи данного заболевания по наследству детям. При этом даже необязательно, чтобы у самого родителя было это заболевание. Будет достаточно и того, чтобы он передал потомству мутированный ген.
Современная медицина позволяет пройти специальные обследования, которые и позволяют выявить данный ген в человеческом организме. С помощью таких анализов можно снизить тревожность в том случае, если кто-то в семье уже заболел раком, а также начать лечение на самых первых стадиях болезни. Ведь в этом случае избавиться от недуга будет намного проще.
Мутации в человеческих генах
Многих людей интересует вопрос, как появляется рак у человека. Одной из причин считается мутация генов, которая происходит благодаря внешним и внутренним факторам. Мутация клеток может происходить совершенно спонтанно и неожиданно или же под воздействием таких факторов, как плохая экология, неправильное питание и ультрафиолетовое излучение.

Если ген начал мутировать, то деятельность клеток начинает ухудшаться, что может привести к их отмиранию. Однако в некоторых случаях клетка может просто не заметить мутацию гена и продолжить свое дальнейшее существование и деление. Поэтому мутация распространяется и на соседние клетки, которые начинают работать совершенно по-другому. Именно так и может появиться рак. Даже самая небольшая мутация в человеческом организме может привести к развитию тяжелых онкологических заболеваний.
Можно ли предохранить себя от онкологии
Отчего появляется рак, было рассмотрено в этой статье. Но также очень важно знать, можно ли предотвратить данное заболевание. К сожалению, никто не может сказать этого точно. Но любой специалист настоятельно рекомендует заняться своим здоровьем и избегать факторов, провоцирующих развитие онкологических заболеваний.
Следите за своим здоровьем, занимайтесь спортом, правильно питайтесь, побольше отдыхайте и вовремя посещайте доктора, и тогда никакие болезни вам не будут страшны. Будьте здоровы. И не забывайте, что рак – это не приговор.
Онкология — это… Что такое Онкология?
онкология — онкология … Орфографический словарь-справочник
ОНКОЛОГИЯ — (греч.). Учение об опухолях. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. онкология (гр. onkos вздутость + …логия) раздел медицины, изучающий причины возникновения опухолей, их происхождение, развитие, а также … Словарь иностранных слов русского языка
ОНКОЛОГИЯ — (от греч. onkos опухоль и logos слово, учение), учение об опухолях. Как вполне самостоятельная глава медиц. науки О. еще молода, несмотря на то что наши сведения об опухолях восходят к древнейшим временам. История О. почти так же стара, как и… … Большая медицинская энциклопедия
ОНКОЛОГИЯ — (от греческого oncos опухоль и…логия), медико биологическая наука, изучающая причины возникновения, механизмы развития и проявления опухолей и разрабатывающая методы их диагностики, лечения и профилактики. Различают экспериментальную,… … Современная энциклопедия
ОНКОЛОГИЯ — (от греч. onkos опухоль и …логия) медико биологическая наука, изучающая теоретические, экспериментальные и клинические аспекты онкогенеза у человека, животных, растений и разрабатывающая методы распознавания, лечения и профилактики опухолей.… … Большой Энциклопедический словарь
ОНКОЛОГИЯ — ОНКОЛОГИЯ, в медицине область, занимающаяся диагностикой и лечением РАКА … Научно-технический энциклопедический словарь
ОНКОЛОГИЯ — ОНКОЛОГИЯ, онкологии, мн. нет, жен. (от греч. ogkos букв. бремя, тяжесть и logos учение) (мед.). Отдел медицины, изучающий опухоли и методы их лечения. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ОНКОЛОГИЯ — ОНКОЛОГИЯ, и, жен. Медико биологическая наука, занимающаяся опухолями, их распознаванием, лечением и профилактикой. | прил. онкологический, ая, ое. О. диспансер. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
онкология — сущ., кол во синонимов: 1 • медицина (189) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
онкология — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN oncology … Справочник технического переводчика
Онкология — (от греческого oncos опухоль и …логия), медико биологическая наука, изучающая причины возникновения, механизмы развития и проявления опухолей и разрабатывающая методы их диагностики, лечения и профилактики. Различают экспериментальную,… … Иллюстрированный энциклопедический словарь

