Строение коллагена: Из чего состоит коллаген и как стимулировать его производство в организме: краткий обзор
Из чего состоит коллаген и как стимулировать его производство в организме: краткий обзор
ИЗ ЧЕГО СОСТОИТ КОЛЛАГЕН И КАК СТИМУЛИРОВАТЬ ЕГО ПРОИЗВОДСТВО В ОРГАНИЗМЕ: КРАТКИЙ ОБЗОР
Ранее мы уже писали о свойствах коллагена, в особенности морского коллагена, и каким образом он положительно влияет на пищеварительную систему, суставы, варикозные вены, а также розацеа. В этих статьях подчеркивается важность и полезность коллагена, а также то, как он помогает нашему организму. В статье «Отличие морского коллагена от других типов. Зачем людям нужны протеины красоты?» мы уже коснулись того, из чего состоит коллаген, а также различий между морским коллагеном и коллагеном иного происхождения. В этой статье мы более подробно рассмотрим, из чего состоит коллаген, то есть, каков его состав. Кроме того, коснемся того, что может помочь коллагену сохранится в организме и способствовать его вырабатыванию.
КАКОВЫ ОСНОВНЫЕ СОСТАВЛЯЮЩИЕ КОЛЛАГЕНА?
Коллаген — это белок. Наш организм состоит из разных типов белков, каждый из которых выполняет свою функцию. Таким образом, белки участвуют в таких процессах, как пищеварение, мышечные и пищеварительные функции и другие. Они образуют структуру клеток и тканей, а также многие ферменты и гормоны. Как мы уже упоминали в предыдущих статьях (подробнее читайте на нашем блоге), коллаген – один из основных белков, и составляет около 1/3 общего количества белка в организме. Коллаген словно клей (а именно такого значение греческого слово
Наш организм состоит из разных типов белков, каждый из которых выполняет свою функцию. Таким образом, белки участвуют в таких процессах, как пищеварение, мышечные и пищеварительные функции и другие. Они образуют структуру клеток и тканей, а также многие ферменты и гормоны. Как мы уже упоминали в предыдущих статьях (подробнее читайте на нашем блоге), коллаген – один из основных белков, и составляет около 1/3 общего количества белка в организме. Коллаген словно клей (а именно такого значение греческого слово
Белки состоят из множества различных аминокислотных цепочек, связанных между собой. Белок состоит из 300 или более различных аминокислот, а также их цепочек, которые и определяют форму белка и его функцию в организме человека. В коллагене аминокислоты расположены уникальным образом. Коллаген состоит в основном из следующих аминокислот: глицина, пролина и гидроксипролина. Кратко о каждой из них:
В коллагене аминокислоты расположены уникальным образом. Коллаген состоит в основном из следующих аминокислот: глицина, пролина и гидроксипролина. Кратко о каждой из них:
- Глицин – белое кристаллическое вещество, растворимое в воде и имеющее сладкий вкус. В большинстве белков глицин содержится в небольших количествах, за исключением коллагена, где он составляет около 25-35% всех аминокислот. В человеческом организме глицин помогает синтезировать антиоксидант глутатион который, в свою очередь, необходим для борьбы со свободными радикалами, которые вызывают окислительный стресс и повреждают клетки и белки. Глицин также участвует в выработке другой аминокислоты, креатина, который, в свою очередь, обеспечивает энергию, необходимую для работы мышц и мозга.
- Пролин также содержится в различных белках, особенно в коллагене.

- Гидроксипролин, как показывают исследования, участвует в синтезе глицина, пирувата и глюкозы. И пролин, и гидроксипролин важны для обеспечивания структуры и функции клеток.5
Поскольку белки в организме постоянно обновляются в процессе синтеза, организму требуется постоянный запас аминокислот.
КАК СТИМУЛИРОВАТЬ ПРОИЗВОДСТВО КОЛЛАГЕНА В ОРГАНИЗМЕ?
После 25 летнего возраста выработка коллагена в человеческом организме начинает замедлятся, что приводит к старению кожи, образованию морщин и ослаблению суставов. Коллаген помогает коже сохранить упругость и влажность, а также способствует регенерации клеток. То есть со временем становится все более важным поддерживать оптимальный уровень коллагена, а также способствовать его выработке в организме. Это возможно , включая в рацион больше следующих веществ:
- Гиалуроновая кислота – важный элемент в поддержании здоровья и молодости кожи.
 Употребление гиалуроновой кислоты стимулирует активность фибробластов, которые, в свою очередь, начинают более активно вырабатывать коллаген. Гиалуроновая кислота содержится в продуктах с высоким содержанием аминокислот, таких как бобы, корнеплоды и соя.
Употребление гиалуроновой кислоты стимулирует активность фибробластов, которые, в свою очередь, начинают более активно вырабатывать коллаген. Гиалуроновая кислота содержится в продуктах с высоким содержанием аминокислот, таких как бобы, корнеплоды и соя. - Витамин С действует в организме человека как антиоксидант и участвует в синтезе коллагена, регулирует пигментацию кожи и помогает поддерживать ровный тон кожи лица в течение всего года. Витамин С содержится в различных цитрусовых, перце, клубнике, папайе, брокколи и различных зеленых листовых овощах.
- Антиоксиданты помогают защитить организм от свободных радикалов и помогают коллагену лучше выполнять свои функции. Антиоксиданты в большом количестве содержатся в таких продуктах, как черника, зеленый чай, экстракт солодки и других.
- Пролин содержится в больших количествах в яичных белках, ростках пшеницы, молочных продуктах, капусте, спарже и грибах.
- Глицин чаще всего встречается в различных продуктах, богатых белком, таких как желатин.
 6,7
6,7
ЧТО ПРЕДЛАГАЕТ МОРСКОЙ КОЛЛАГЕН COL DU MARINETM ?
Пептиды морского коллагена Col Du Marine™ содержат в основном глицин, пролин и гидроксипролин. Они имеют низкую молекулярную массу, что делает их легко усваиваемыми организмом. Пептиды морского коллагена Col Du Marine™ легко употребляются в пищу и растворяются в любом напитке и пище, его можно легко добавить в ваш ежедневный рацион. Пептиды морского коллагена Col Du Marine™ имеют нейтральный вкус и запах.
Col Du Marine™ в новом золотом саше также содержит гиалуроновую кислоту, витамин С и кремний из экстракта ростков бамбука, что принесет еще больше пользы вашему организму! Подробнее о нашей новой формуле читайте здесь.
Посетите наш магазин и попробуйте пептиды морского коллагена Col Du Marine™ уже сегодня!
Источники:
- Collagen — What Is It and What Is It Good For?, https://www.healthline.com/nutrition/collagen#what-it-is
- What Are Proteins and What Is Their Function in the Body?, https://www.
 eufic.org/en/whats-in-food/article/what-are-proteins-and-what-is-their-function-in-the-body
eufic.org/en/whats-in-food/article/what-are-proteins-and-what-is-their-function-in-the-body - Health Benefits of Glycine, https://www.webmd.com/diet/health-benefits-glycine#1
- Proline, https://www.webmd.com/vitamins/ai/ingredientmono-1620/proline
- Wu, G., Bazer, F. W., Burghardt, R. C., Johnson, G. A., Kim, S. W., Knabe, D. A., Li, P., Li, X., McKnight, J. R., Satterfield, M. C., & Spencer, T. E. (2011). Proline and hydroxyproline metabolism: implications for animal and human nutrition. Amino acids, 40(4), 1053–1063. https://doi.org/10.1007/s00726-010-0715-z (источник:
- Ways to get healthier looking skin by boosting collagen levels, https://www.medicalnewstoday.com/articles/317151#Ways-to-boost-collagen
- Collagen — What Is It and What Is It Good For?, https://www.healthline.com/nutrition/collagen#nutrients-that-increase-collagen
Collagen Type I (COL1) — Коллаген 1 типа
Коллаген — фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т.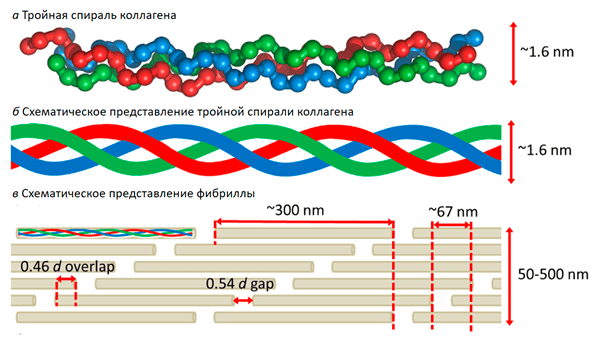 п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у многоклеточных животных; отсутствует у растений, бактерий, вирусов, простейших и грибов. Коллаген — основной компонент соединительной ткани и самый распространённый белок у млекопитающих, составляющий от 25 % до 35 % белков во всём теле. Молекула коллагена представляет собой правозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм. Коллаген существует в нескольких формах. Основа строение всех видов коллагена является схожей. Коллагеновые волокна образуются путём агрегации микрофибрилл, имеют розовый цвет при окраске гематоксилином и эозином и голубой или зелёный при различных трёххромных окрасках, при импрегнации серебром окрашиваются в буро-жёлтый цвет. В настоящее время описано 28 типов коллагена, которые кодируются более чем 40 генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации — интенсивности гидроксилирования или гликозилирования.
п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у многоклеточных животных; отсутствует у растений, бактерий, вирусов, простейших и грибов. Коллаген — основной компонент соединительной ткани и самый распространённый белок у млекопитающих, составляющий от 25 % до 35 % белков во всём теле. Молекула коллагена представляет собой правозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм. Коллаген существует в нескольких формах. Основа строение всех видов коллагена является схожей. Коллагеновые волокна образуются путём агрегации микрофибрилл, имеют розовый цвет при окраске гематоксилином и эозином и голубой или зелёный при различных трёххромных окрасках, при импрегнации серебром окрашиваются в буро-жёлтый цвет. В настоящее время описано 28 типов коллагена, которые кодируются более чем 40 генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации — интенсивности гидроксилирования или гликозилирования. Общим для всех коллагенов является существование 1 или более доменов, содержащих тройную спираль и присутствие их во внеклеточном матриксе. Более 90 % всего коллагена высших организмов приходится на коллагены I, II,III и IV типов.
Общим для всех коллагенов является существование 1 или более доменов, содержащих тройную спираль и присутствие их во внеклеточном матриксе. Более 90 % всего коллагена высших организмов приходится на коллагены I, II,III и IV типов.
Организм
Артикул
Наименование
В наличии
ELISA Kit for Collagen Type I (COL1)
Организм:
ЧеловекАртикул:
SEA571HuELISA Kit for Collagen Type I (COL1)
В наличии:
High Sensitive ELISA Kit for Collagen Type I (COL1)
Организм:
ЧеловекАртикул:
HEA571HuHigh Sensitive ELISA Kit for Collagen Type I (COL1)
В наличии:
ELISA Kit for Anti-Collagen Type I Antibody (Anti-COL1)
Организм:
ЧеловекАртикул:
AEA571HuELISA Kit for Anti-Collagen Type I Antibody (Anti-COL1)
В наличии:
ELISA Kit for Collagen Type I (COL1)
Организм:
КрысаАртикул:
SEA571RaELISA Kit for Collagen Type I (COL1)
В наличии:
ELISA Kit for Collagen Type I (COL1)
Организм:
МышьАртикул:
SEA571MuELISA Kit for Collagen Type I (COL1)
В наличии:
ELISA Kit for Collagen Type I (COL1)
Организм:
ЛошадьАртикул:
CEA571EqELISA Kit for Collagen Type I (COL1)
В наличии:
ELISA Kit for Collagen Type I (COL1)
Организм:
ЛошадьАртикул:
SEA571EqELISA Kit for Collagen Type I (COL1)
В наличии:
ELISA Kit for Collagen Type I (COL1)
Организм:
КроликАртикул:
SEA571RbELISA Kit for Collagen Type I (COL1)
В наличии:
Организм
Артикул
Наименование
В наличии
Polyclonal Antibody to Collagen Type I (COL1)Применение:
вестерн-блот; иммуногистохимия; иммуноцитохимия; иммунопреципитация
Организм:
КрысаАртикул:
PAA571Ra01В наличии:
Labelled Antibody to Collagen Type I (COL1)Применение:
Организм:
КрысаАртикул:
LAA571Ra71Labelled Antibody to Collagen Type I (COL1)
В наличии:
УточнитьPolyclonal Antibody to Collagen Type I (COL1)Применение:
вестерн-блот; иммуногистохимия; иммуноцитохимия; иммунопреципитация.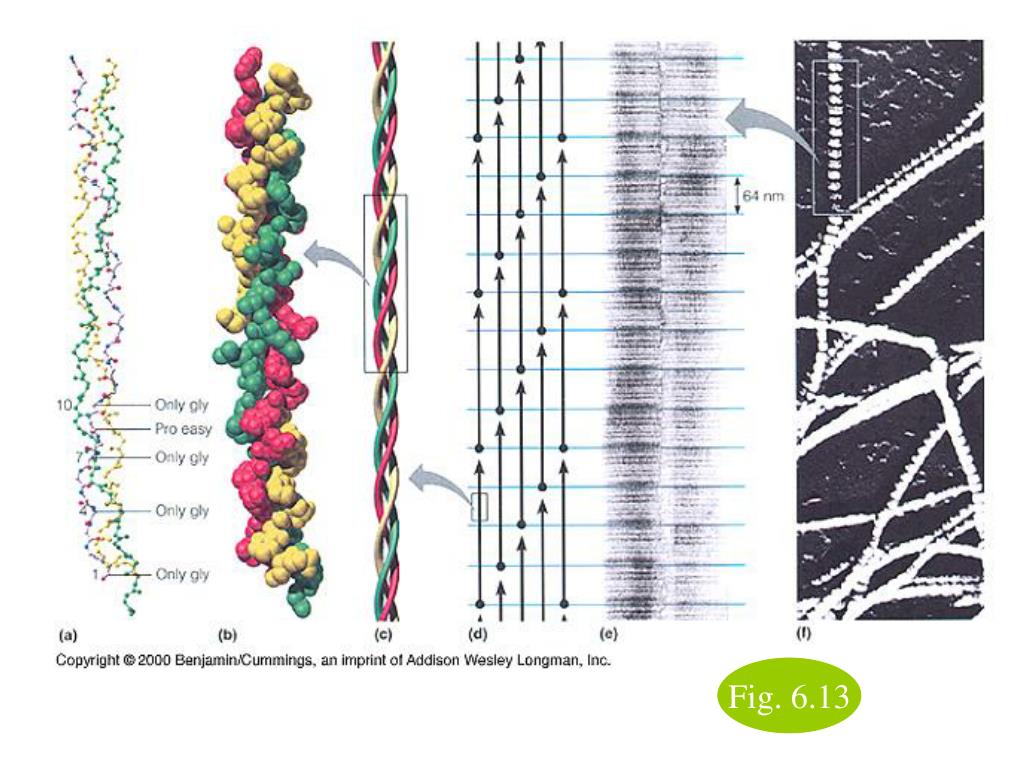
Организм:
МышьАртикул:
PAA571Mu01В наличии:
Collagen I AntibodyПрименение:
вестерн-блот; иммуногистохимия, иммунофлюоресценция/ иммуноцитохимия, иммуноферментный анализ
Организм:
Человек, Мышь, КрысаАртикул:
AF0134В наличии:
Collagen I AntibodyПрименение:
вестерн-блот; иммуногистохимия, иммунофлюоресценция/ иммуноцитохимия, иммуноферментный анализ
Организм:
Человек, Мышь, КрысаАртикул:
AF7001В наличии:
Polyclonal Antibody to Collagen Type I (COL1)Применение:
Организм:
ЧеловекАртикул:
PAA571Hu01Polyclonal Antibody to Collagen Type I (COL1)
В наличии:
УточнитьLabelled Antibody to Collagen Type I (COL1)Применение:
Организм:
ЧеловекАртикул:
LAA571Hu71Labelled Antibody to Collagen Type I (COL1)
В наличии:
УточнитьОрганизм
Артикул
Наименование
В наличии
Native Collagen Type I (COL1)
Организм:
ЧеловекАртикул:
NPA571Hu01Native Collagen Type I (COL1)
В наличии:
Native Collagen Type I (COL1)
Организм:
КрысаАртикул:
NPA571Ra01Native Collagen Type I (COL1)
В наличии:
Если вы не увидели здесь нужный Вам продукт — это значит, что он доступен для изготовления на заказ.
Обратный звонок
Чат со специалистом
Напишите нам
Московский государственный университет
Исследовательский центр им.Алмазова
НЦ вирусологии и биотехнологии «Вектор»
Институт медико-биологических проблем РАН
Институт Цитологии и Генетики СО РАН
Институт физиологии им. Павлова
Сеченовский Университет
МНТК Микрохирургии глаза им.Федорова
МФТИ
Институт экспериментальной медицины
Исследовательский центр им. Дмитрия Рогачева
НИЦ Курчатовский институт
Петербургский институт ядерной физики им. Б.П.Константинова
НИИ глазных болезней им. Гельмгольца
НЦ акушерства, гинекологии и перинатологии им.Кулакова
ИЭФБ РАН им.Сеченова
Национальный исследовательский университет Лобачевского
Томский научный исследовательский медицинский центр
Казанский Федеральный Университет
СЗГМУ им.Мечникова
Балтийский федеральный университет
Научный центр неврологии
Северо-Кавказский федеральный университет
Дальневосточный федеральный университет
ФНКЦ физико-химической медицины
ФНКЦ реаниматологии и реабилитологии
Сибирский федеральный университет
Институт биологии гена РАН
ФИЦ Питания и биотехнологий
Сибирский медицинский университет
Институт биофизики клетки РАН
НИПИ им. Бехтерева
Бехтерева
Институт Фундаментальных Проблем Биологии РАН
Институт токсикологии ФМБА России
НИИ Акушерства и гинекологии им. Отта
НИИ Психического здоровья
РМАПО
Красноярский медицинский университет им. Войно-Ясенецкого
Алтайский медицинский университет
Ниармедик
Волгоградский медицинский университет
Новосибирский медицинский университет
РНИОИ
ИБХ РАН им. акад. Шемякина и Овчинникова
Петровакс Фарм
Южно-Уральский государственный университет
ПИМУ
ФНЦ Пищевых систем им.Горбатова РАН
Биохимия, синтез коллагена — StatPearls
Марлин Ву; Келли Кронин; Джонатан С. Крейн.
Информация об авторе и организацияхПоследнее обновление: 12 сентября 2022 г.
Введение
Коллаген представляет собой белковые молекулы, состоящие из аминокислот. Он обеспечивает структурную поддержку внеклеточного пространства соединительной ткани. Благодаря своей жесткости и устойчивости к растяжению он является идеальной матрицей для кожи, сухожилий, костей и связок.
Коллаген можно разделить на несколько групп в зависимости от типа структур, которые они образуют. Было обнаружено 28 различных типов коллагена, но на сегодняшний день наиболее распространенными являются типы с I по IV, при этом тип I составляет более 90% коллагена в организме человека.[1][2][3]
Основы
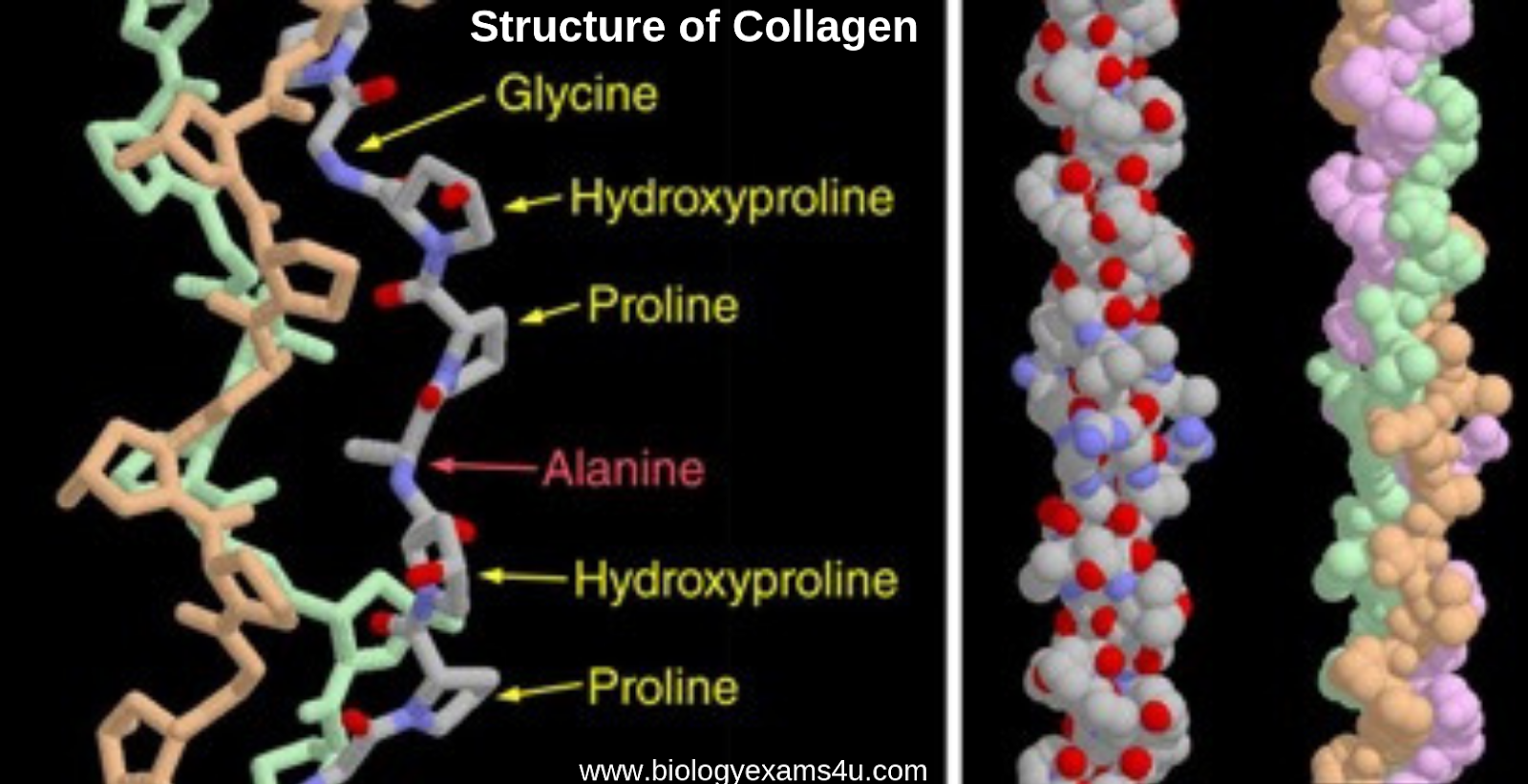
Аминокислоты являются строительными блоками белков; поэтому неудивительно, что коллаген состоит из аминокислот [4]. Первичная аминокислотная последовательность коллагена представляет собой глицин-пролин-X или глицин-X-гидроксипролин [5] 9.0003
X может быть любой из 17 других аминокислот, а каждая третья аминокислота представляет собой глицин.
Коллаген состоит из 3 цепей. Цепи намотаны вместе, образуя тройную спираль. Поскольку глицин является наименьшей из всех аминокислот, он позволяет цепи формировать плотную конфигурацию, и она может противостоять стрессу.
Процесс синтеза коллагена происходит в основном в клетках фибробластов, которые являются специализированными клетками с основной функцией синтеза коллагена и стромы. Синтез коллагена происходит как внутриклеточно, так и внеклеточно. Хотя разные типы коллагена могут подвергаться различным посттрансляционным модификациям, основные принципы синтеза коллагена перечислены ниже.
Синтез коллагена происходит как внутриклеточно, так и внеклеточно. Хотя разные типы коллагена могут подвергаться различным посттрансляционным модификациям, основные принципы синтеза коллагена перечислены ниже.
Проблемы, вызывающие озабоченность
Как и в любом биохимическом пути, существует множество шагов, которые тщательно выполняются и строго регулируются и контролируются. Однако при многих этапах обработки коллагена могут возникать генетические мутации, которые могут привести к ошибкам в сборке, посттрансляционной модификации или дефициту питательных веществ, которые могут повлиять на ферментативную функцию. Некоторые примеры включают:
Несовершенный остеогенез, который представляет собой аутосомно-доминантное заболевание коллагена 1 типа, которое может проявляться спектром признаков от легкой до летальной. Синдром Элерса-Данлоса, который также является наследственным заболеванием коллагена с по крайней мере 6 различными подтипами с различными мутациями разных типов коллагена.
Сотовый уровень
Внутриклеточный
Транскрипция мРНК в ядре
Перевод
мРНК перемещается в цитоплазму и взаимодействует с рибосомами для трансляции.
После трансляции ее называют пре-про-полипептидной цепью; затем эта цепь перемещается в эндоплазматический ретикулум (ЭР) для посттрансляционной модификации.
Посттрансляционная модификация
Попав в ER, пре-про-полипептид подвергается посттрансляционному процессингу, при котором в пре-про-полипептид вносятся три основные модификации, чтобы он стал про-коллагеном.
Сигнальный пептид на N-конце удален
К остаткам лизина и пролина добавляются дополнительные гидроксильные группы с помощью ферментов гидроксилаз, которым необходим витамин С в качестве кофактора
Гликозилирование выбранных гидроксильных групп лизина с галактозой и глюкозой b
Три гидроксилированные и гликозилированные про-цепи собираются путем скручивания в тройную спираль, образуя застежку-молнию.
 Конфигурация тройной спирали представляет собой 3 левозакрученные спирали, закрученные в правозакрученный виток
Конфигурация тройной спирали представляет собой 3 левозакрученные спирали, закрученные в правозакрученный витокТеперь молекула проколлагена готова к перемещению в аппарат Гольджи для финальных модификаций и сборки в секреторные везикулы для выхода во внеклеточное пространство
Внеклеточный
Расщепление пропептида
Ферменты, известные как пептидазы коллагена, преформируют расщепление пропептида и удаляют концы молекулы проколлагена, и молекула становится тропоколлагеном
Сборка коллагеновых волокон
Лизилоксидаза, медьзависимый фермент, действует на лизин и гидроксилизины, а ковалентная связь между молекулами тропоколлагена образует коллагеновую фибриллу
Функция
Коллаген является наиболее распространенным белком в организме человека. Поэтому его можно разделить на множество видов. Наиболее распространенными типами коллагена являются типы с I по V, каждый из которых выполняет разные функции.
Клиническое значение
Как обсуждалось ранее, биохимический синтез коллагена вызывает озабоченность. Нарушения синтеза коллагена могут проявляться клиническими проявлениями. Несколько известных заболеваний — цинга, несовершенный остеогенез и синдром Элерса-Данлоса.
Цинга
Дефицит водорастворимого витамина С или аскорбиновой кислоты в питании чаще всего вызывает цингу. Цинга редко встречается в развивающихся странах и в основном встречается у младенцев, пожилых людей и алкоголиков, у всех из которых может быть недостаточное питание и недоедание.
Пациенты могут жаловаться на общую утомляемость, слабость, плохое заживление ран, анемию и заболевания десен. Клинически один из первых признаков цинги возникает на коже и проявляется в виде перифолликулярного кровоизлияния, при котором фолликулы кожи закупориваются кератином. Эти области выглядят как кровоподтеки вокруг волосяных фолликулов. Также могут быть хрупкие волоски, расположенные штопором. Цинга диагностируется клинически на основании диетического анамнеза, а рентгенография может показать поднадкостничное кровоизлияние или истончение коры. Уровни аскорбиновой кислоты менее 11 микромоль/л могут помочь подтвердить диагноз. Лечение заключается в добавлении витамина С и диете, включающей помидоры, цитрусовые и другие овощи с высоким содержанием витамина С.
Цинга диагностируется клинически на основании диетического анамнеза, а рентгенография может показать поднадкостничное кровоизлияние или истончение коры. Уровни аскорбиновой кислоты менее 11 микромоль/л могут помочь подтвердить диагноз. Лечение заключается в добавлении витамина С и диете, включающей помидоры, цитрусовые и другие овощи с высоким содержанием витамина С.
Несовершенный остеогенез (OI )
Это семейство генетических нарушений, которые поражают кости, делая их слабыми и легко ломаемыми. Наследование аутосомно-доминантное, и в большинстве случаев происходит из-за мутаций в генах COL1A1 или COL1A2 . Существует 8 типов, каждый из которых имеет разную степень тяжести: тип 1 — самый легкий, а тип II — самый тяжелый.[7]
Генные мутации влияют на образование проколлагена, в котором небольшая аминокислота глицин заменяется более объемными аминокислотами, которые изменяют структуру тройной спирали коллагена.
НО поражает 1 из 15 000 человек, диагноз ставится клинически и может быть подтвержден анализом ДНК или коллагена. Прогноз зависит от типа НО. Излечения не существует, и лечение является поддерживающим и основано на предотвращении переломов. Было показано, что бисфосфонаты, хирургия и физиотерапия помогают.
Прогноз зависит от типа НО. Излечения не существует, и лечение является поддерживающим и основано на предотвращении переломов. Было показано, что бисфосфонаты, хирургия и физиотерапия помогают.
Синдром Элерса-Данлоса (EDS )
Это группа наследственных заболеваний соединительной ткани, которыми страдает примерно 1 из 5000 человек во всем мире. Существует 13 СЭД, и признаки и симптомы различаются в зависимости от типа СЭД. Большинство форм СЭД наследуются аутосомно-доминантно, а мутации находятся в COL1A1, COL1A2, COL1A2, COL3A1, COL5A1, и многие другие. Мутации в генах влияют на расщепление внеклеточных пептидов и изменяют перекрестное связывание и агрегацию коллагеновых фибрилл, что вызывает изменение стабильности и функциональности волокон.[8]
В зависимости от генетической мутации и типа пораженных коллагеном пациентов могут проявляться различные клинические проявления; однако у пациентов с СЭД есть некоторые общие проявления, которые варьируются от легких до угрожающих жизни.
Диагноз ставится клинически, в качестве дополнения могут использоваться исследования ДНК и исследования мутаций коллагена. Прогноз во многом зависит от типа ЭДС у пациента. Однако лекарства от СЭД нет, и лечение является поддерживающим.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Нагаока И., Цурута А., Йошимура М. Хондропротекторное действие глюкозамина, мономера хитозана, на здоровье суставов спортсменов. Int J Биол Макромоль. 2019 01 июля; 132: 795-800. [PubMed: 30940583]
- 2.
Мякитие Р.Е., Костантини А., Кампе А., Альм Дж.Дж., Мякитие О. Новое понимание моногенных причин остеопороза. Фронт Эндокринол (Лозанна). 2019;10:70. [Бесплатная статья PMC: PMC6397842] [PubMed: 30858824]
- 3.
Субраманиан С., Вишванатан В.К. StatPearls [Интернет].
 Издательство StatPearls; Остров сокровищ (Флорида): 20 октября 2022 г. Несовершенный остеогенез. [PubMed: 30725642]
Издательство StatPearls; Остров сокровищ (Флорида): 20 октября 2022 г. Несовершенный остеогенез. [PubMed: 30725642]- 4.
Сагалейни С.Х., Дехган К., Шадвар К., Санайе С., Махмудпур А., Остади З. Пролежни и питание. Indian J Crit Care Med. 2018 апр; 22 (4): 283-289. [Бесплатная статья PMC: PMC5930532] [PubMed: 29743767]
- 5.
Шульц П. Оборот костей: биология и инструменты оценки. Best Pract Res Clin Endocrinol Metab. 2018 окт; 32 (5): 725-738. [PubMed: 30449551]
- 6.
Хоулберг К., Викенден Дж., Фрешуотер Д. Пять веков медицинского вклада Королевского флота. Клин Мед (Лондон). 2019 янв;19(1):22-25. [PMC free article: PMC6399651] [PubMed: 30651240]
- 7.
Semler O, Rehberg M, Mehdiani N, Jackels M, Hoyer-Kuhn H. Текущие и выявляющиеся терапевты для управления редкими скелетами. Педиатрические препараты. 201921 апреля (2): 95-106. [PubMed: 30941653]
- 8.
Cortini F, Villa C, Marinelli B, Combi R, Pesatori AC, Bassotti A.
 Понимание основ синдрома Элерса-Данлоса в эпоху секвенирования следующего поколения. Арка Дерматол Рез. 2019 май; 311(4):265-275. [PubMed: 30826961]
Понимание основ синдрома Элерса-Данлоса в эпоху секвенирования следующего поколения. Арка Дерматол Рез. 2019 май; 311(4):265-275. [PubMed: 30826961]
Структура коллагена | Природа
- Опубликовано:
- Г. Н. РАМАЧАНДРАН 1 и
- ГОПИНАТ КАРТА 1
Природа том 176 , страницы 593–595 (1955)Цитировать эту статью
1617 доступов
453 Цитаты
16 Альтметрический
Сведения о показателях
Это предварительный просмотр содержимого подписки, доступ через ваше учреждение.
Соответствующие статьи
Статьи открытого доступа со ссылками на эту статью.
Дизайн синтетических коллагенов, которые собираются в супрамолекулярные ленточные волокна, в качестве испытательного полигона функционального биоматериала
- Цзиньюань Ху
- , Джунху Ли
- … Фей Сюй
Связь с природой Открытый доступ 09 ноября 2022 г.
Связь структурных и композиционных изменений в археологическом коллагене костей человека: подход FTIR-ATR
- Антонио Мартинес Кортисас
- и Олалла Лопес-Костас
Научные отчеты Открытый доступ 21 октября 2020 г.
Первые доказательства нанокомплекса октакальцийфосфат@остеокальцин в качестве компонента скелетной кости, направляющего минерализацию нанофибрилл тройной спирали коллагена
- Пауль Симон
- , Даниэль Грюнер
- … Рюдигер Книп
Научные отчеты Открытый доступ 12 сентября 2018 г.
Варианты доступа
Подпишитесь на этот журнал
Получите 51 печатный выпуск и онлайн-доступ
199,00 € в год
всего 3,90 € за выпуск
Узнать больше
Взять напрокат или купить эту статью
Получите только эту статью столько, сколько вам нужно
$39,95 облагается местными налогами, которые рассчитываются во время оформления заказа.
Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Коуэн, П., Норт, А. С. Т., и Рэндалл, Дж. Т., « Природа и структура коллагена «, 241 (Баттерворт, 1953).
Google Scholar
Crick, F.H.C., Acta Cryst. , 6 , 689 (1952).
Артикул Google Scholar
Рамачандран Г. Н. и Амбади Г. К., Curr. наук , 23 , 349(1954).
Google Scholar
Yakel, H.L., and Schatz, P.N., Acta Cryst. , 8 , 22 (1955).
Артикул КАС Google Scholar
Sutherland, G.B.B.M., Tanner, K.N., and Wood, D.L., J. Chem. физ. , 22 , 1621 (1954).
Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Ramachandran, G. N., J. Chem. физ. , 23 , 600 (1955).
N., J. Chem. физ. , 23 , 600 (1955).
Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Gustavson, K.H., Nature , 175 , 70 (1955).
Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Роугви, Массачусетс, и Беар, Р.С., J. Amer. Кожа Хим. доц. , 48 , 735 (1953).
КАС Google Scholar
Nutting, G.C., and Borasky, R., J. Amer. Кожа Хим. доц. , 43 , 96 (1948).
КАС Google Scholar
Кэсберг П. и Шурман М.М., Биохим. Биофиз. Acta , 11 , 1 (1953).
Артикул КАС Google Scholar
North, A.C.T., Cowan, P. M., and Randall, J.T., Nature , 174 , 1142 (1954).
M., and Randall, J.T., Nature , 174 , 1142 (1954).
Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Скачать ссылки
Информация об авторе
Авторы и организации
Факультет физики Мадрасского университета, Мадрас, 25
Г. Н. РАМАЧАНДРАН & ГОПИНАТ КАРТА
- Г. Н. РАМАЧАНДРАН
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- GOPINATH KARTHA
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Права и разрешения
Перепечатка и разрешения
Об этой статье
Эта статья цитируется
Дизайн синтетических коллагенов, которые собираются в супрамолекулярные ленточные волокна, в качестве испытательного полигона функционального биоматериала
- Цзиньюань Ху
- Цзюньху Ли
- Фэй Сюй
Связь с природой (2022)
Конформационный анализ коллагеноподобных олигопептидов Co-Glycine/L-proline с помощью квантово-химического расчета (QCC): влияние последовательности на конформации и внутримолекулярные водородные связи
- Минору Кобаяши
- Джэ Хо Сим
- Хисая Сато
Бюллетень полимеров (2022)
Связь структурных и композиционных изменений в археологическом коллагене костей человека: подход FTIR-ATR
- Антонио Мартинес Кортисас
- Олалла Лопес-Костас
Научные отчеты (2020)
Первые доказательства нанокомплекса октакальцийфосфат@остеокальцин в качестве компонента скелетной кости, направляющего минерализацию нанофибрилл тройной спирали коллагена
- Пол Симон
- Даниэль Грюнер
- Рюдигер Книп
Научные отчеты (2018)
Физико-химические свойства кислото- и пепсинорастворимых коллагенов хрящей сибирского осетра
- Цянь-Бин Луо
- Чанг-Фэн Чи
- Бин Ван
Науки об окружающей среде и исследования загрязнения (2018)
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества.

